人类对血型系统的探索始于20世纪初,但直到今天,这一领域仍不断刷新着医学界的认知。自1901年奥地利科学家兰德斯泰纳发现ABO血型以来,科学家们已陆续揭示出44种不同的血型系统,这些系统构成了人类血液多样性的复杂图谱。每个血型系统都代表着红细胞表面特定抗原的组合模式,这些微小的糖蛋白分子不仅决定着输血安全,更与疾病易感性、遗传特征等生命奥秘紧密相连。
一、血型系统的科学架构
血型系统的本质是红细胞膜上的抗原分类组合,这些抗原由遗传基因编码,具有高度特异性。目前国际输血协会(ISBT)确认的44个血型系统中,每个系统都独立受控于不同染色体上的基因位点。例如ABO基因位于9号染色体,而Rh系统的RHD基因则位于1号染色体。这种基因多样性使得血型呈现多态性特征,全球范围内已发现超过300种血型抗原。
在众多血型系统中,ABO和Rh因其临床重要性被列为输血医学的基石。ABO系统通过A、B抗原的存在与否将血液分为四类,而Rh系统则依据D抗原的阳性或阴性划分。值得注意的是,每个系统内部还存在亚型变异,如A型血中已发现A1、A2等20余种亚型,B型血也有B3、Bx等罕见亚型。这些微观差异要求现代血型检测必须采用血清学与基因检测相结合的方法,以确保输血安全。
二、ABO系统的遗传密码
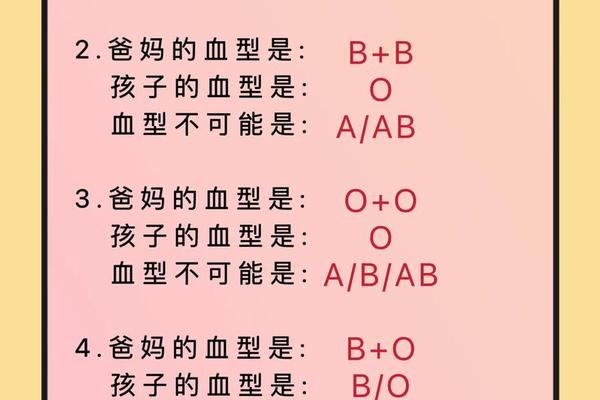
作为人类最早发现的血型系统,ABO的遗传机制已被完全破译。该系统由IA、IB、i三个等位基因控制,遵循经典的孟德尔遗传规律。基因型IAIA或IAi表现为A型血,IBIB或IBi表现为B型血,IAIB基因型形成AB型,而ii纯合体则呈现O型特征。这种显隐性关系造就了"父母均为O型,子女必为O型"等遗传现象,但也存在罕见的顺式AB等特殊遗传模式。
抗原的分子基础源于糖基转移酶的催化作用。A型个体携带的N-乙酰半乳糖胺转移酶能将前体物质转化为A抗原,B型个体的半乳糖转移酶则催化形成B抗原。当两种酶同时存在时产生AB型,而O型因缺乏活性酶保留原始的H抗原结构。这种分子机制的阐明不仅解释了血型差异的本质,也为器官移植配型提供了理论依据。
三、Rh系统的临床价值
Rh血型系统的复杂性远超ABO系统,其抗原由RHD和RHCE两个紧密连锁的基因共同调控。D抗原的免疫原性最强,Rh阴性个体仅占我国汉族人口的0.3%-0.4%,这种稀有性使得"熊猫血"成为临床输血的关注重点。当Rh阴性孕妇怀有Rh阳性胎儿时,胎儿的红细胞可能通过胎盘进入母体,刺激产生抗D抗体,导致新生儿溶血病。
除D抗原外,C、c、E、e抗原的临床意义日益凸显。研究发现抗-E抗体的产生概率甚至超过抗-D,这提示输血前需要更全面的血型筛查。现代输血医学要求对献血者和受血者实施双重确认:献血者Rh阴性需经抗球蛋白试验验证,而受血者初筛阴性即按阴性处理,这种差异化管理体现了血型系统的精密要求。
四、血型研究的多元延伸
血型系统的应用已突破输血医学的边界。流行病学研究显示,B型和AB型人群感染肺结核的风险是O型血的2.04倍和1.46倍,这种关联可能与抗原分子影响病原体黏附有关。在法医学领域,血型基因多态性为亲子鉴定提供辅助证据,尽管其精确度远低于DNA检测。进化人类学研究发现,O型血起源于6万年前的采集者,A型伴随农业革命出现,B型则与游牧文明扩散相关。
当前研究正朝着两个方向深入:一是探idd、Duffy等次要血型系统在疟疾抵抗等特殊生理功能中的作用;二是开发通用型人工血液,通过酶处理消除ABO抗原,这种技术已在动物试验中取得突破。基因编辑技术的进步更使定制化血型成为可能,2023年日本团队成功将A型红细胞转化为O型,转化效率达到97%。
五、未来展望与挑战
面对44个血型系统构成的庞大网络,研究者仍需攻克诸多难题。约30%的血型抗原功能尚未明确,稀有血型的分子机制研究受限于样本稀缺。在临床层面,建立全国性稀有血型库、完善自体输血体系成为当务之急。基础研究领域,血型抗原与免疫系统的相互作用机制、血型对肠道菌群的影响等新兴课题,正在打开新的科研维度。
从输血安全到疾病预防,从人类迁徙史到个体化医疗,血型系统持续展现着其跨越时空的科学魅力。正如诺贝尔奖得主兰德斯泰纳所言:"血液中的密码,是人类认识自身生物本质的重要线索。"在精准医学时代,破解这些密码将为人类健康带来更多突破性进展。


