血型是人类血液分类的重要依据,其差异主要源于红细胞表面抗原的不同。ABO血型系统将血液分为A型、B型、AB型和O型,其中A型血指红细胞表面仅携带A抗原的类型。而"A+"血型则是在ABO系统的基础上结合Rh血型系统的分类,即A型且Rh阳性,其红细胞同时携带A抗原和D抗原。值得注意的是,日常语境中常将"A型血"与"A型"混用,但严格来说,"A型"仅指ABO系统中的分类,而"A型血"可能包含Rh阳性和阴性两种亚型(即A+和A-)。这种差异在输血医学和遗传学中具有关键意义。
从抗原组成来看,A型血的核心特征是红细胞表面存在A抗原,血清中含抗B抗体;而A+血型不仅具备A抗原,还携带Rh系统的D抗原。Rh血型系统的阳性与阴性由D抗原的有无决定,因此A+血型的D抗原使其在输血兼容性上与Rh阴性血型(如A-)形成显著差异。例如,A+血型者可接受A+和O+的血液,但若输入Rh阴性血液可能引发免疫反应。
二、输血医学中的临床应用差异
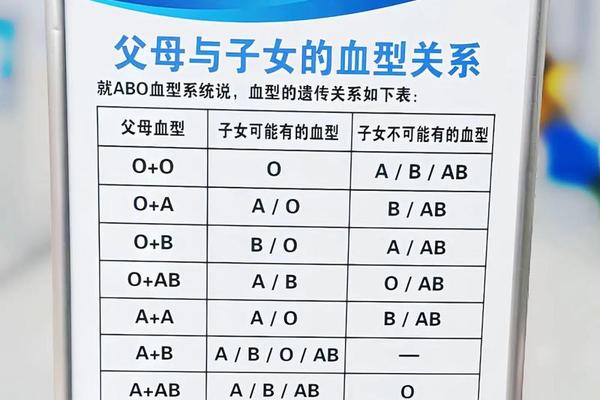
在输血实践中,A+血型与A型血的区分直接影响治疗方案的安全性。Rh血型的不匹配可能引发溶血反应,例如Rh阴性患者输入Rh阳性血液后,体内会产生抗D抗体,导致红细胞破裂。A+血型的供血仅能用于Rh阳性患者,而A型血中的Rh阴性亚型(A-)则需严格匹配Rh阴性受血者。这种限制在紧急输血和稀有血型管理中尤为关键。
临床案例显示,ABO与Rh系统的双重检测可避免90%以上的输血事故。例如,A+血型者若误输给A-患者,可能引发寒战、血红蛋白尿甚至肾功能衰竭。相比之下,单纯ABO系统内的A型血输注(如A+输给A+)风险较低,但仍需通过交叉配血试验排除亚型干扰。例如A型血中的A1和A2亚型抗原强度不同,可能导致血清学检测误差。
三、遗传机制与群体分布特征
从遗传学角度,ABO血型由9号染色体上的IA、IB、i基因控制,而Rh血型由1号染色体的RHD基因决定。A型血的遗传遵循显性规律,父母若分别携带IA和i基因,子代有50%概率为A型;而A+血型需同时继承IA基因和RHD基因。这种双重遗传机制使得A+血型在人群中的分布呈现地域差异:中国约99%的A型血为Rh阳性(即A+),而欧美人群中Rh阴性比例可达15%。
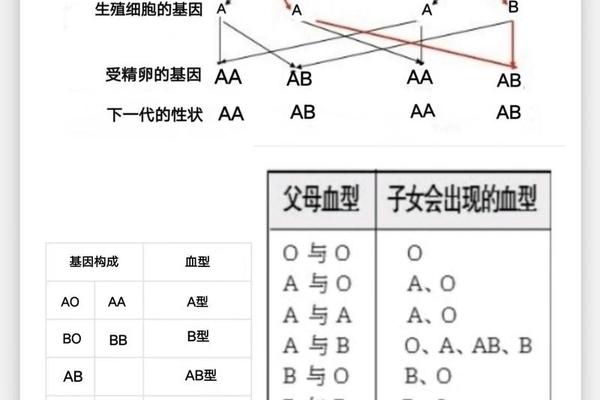
群体研究还发现,A型血的亚型分布与疾病易感性相关。例如A1亚型(常见于A+血型)与胃癌风险呈正相关,而A2亚型携带者更易出现凝血功能异常。这些差异可能与抗原的糖链结构有关——A1亚型的A抗原表达更完整,影响细胞信号传导和免疫应答。
四、检测技术发展带来的认知革新
传统血清学检测通过抗A、抗B及抗D试剂鉴定血型,但可能遗漏亚型信息。例如A2型因抗原表达弱,易被误判为O型。分子生物学技术的应用解决了这一难题:PCR检测可精准识别ABO基因的SNP位点及RHD基因缺失,将A型血的亚型分类从2种扩展至20余种。这对造血干细胞移植和法医学鉴定具有重要意义。
近年来,质谱技术进一步揭示了血型抗原的糖基化修饰差异。研究发现,A+血型红细胞的膜蛋白中,带3蛋白和葡萄糖转运蛋白的N-糖链末端特异性连接A抗原,而D抗原通过跨膜结构域锚定在脂质双层中。这种结构差异解释了为何Rh血型不合引发的溶血反应更具破坏性——D抗原直接参与细胞膜稳定性维持。
五、未来研究方向与临床启示
随着精准医学的发展,血型研究正从群体分类转向个体化应用。例如基于A型血亚型的血小板输注匹配策略,可将输注有效率从78%提升至95%。基因编辑技术为Rh血型改造提供可能:通过CRISPR-Cas9敲除RHD基因,可将A+血型转化为通用型A-,缓解稀有血型储备压力。
对临床实践的建议包括:①常规血型检测应同时涵盖ABO和Rh系统,并备注亚型信息;②建立区域性稀有血型数据库,尤其关注A-等低频血型;③开展公众教育,纠正"A型血含B抗原"等错误认知(如网页15所述内容需勘误)。未来的研究可深入探索血型抗原与肿瘤免疫治疗的关联,例如利用A抗原特异性CAR-T细胞靶向治疗A型血相关的恶性肿瘤。
血型系统的复杂性远超传统认知,A型、A+与A型血的差异本质是分类维度的不同。ABO系统定义抗原种类,Rh系统补充抗原属性,而亚型检测则揭示分子层面的精细差异。这种多层级分类体系在输血安全、疾病诊疗和人类遗传学研究中的价值日益凸显。随着检测技术的进步,我们有望实现从"血型匹配"到"抗原适配"的跨越,真正达成个体化医疗的终极目标。


