在医学与遗传学领域,血型始终是充满神秘色彩的话题。一方面,随着生物技术的发展,科学家尝试通过酶工程将A型血转化为“万能血”O型,甚至探索血型转换的可能性;传统血型遗传规律中“两个B型血父母能否生出AB型孩子”的疑问,因罕见遗传现象的发现而引发热议。这些问题不仅关乎基础科学认知,更与临床输血安全、遗传咨询等现实问题密切相关。本文将从血型转换的可行性、遗传规律的例外性、技术应用的挑战性以及与未来方向四大维度,展开深度剖析。
一、血型转换的生物学基础
血型的本质是红细胞表面抗原的差异。A型血的红细胞携带A抗原,B型血携带B抗原,而O型血则缺乏这两种抗原。传统观念认为,血型由基因决定且终生不变,但近年研究揭示了两种可能的转换途径:酶催化技术与干细胞移植。
酶催化技术的突破源自肠道微生物的启发。丹麦与瑞典团队发现,嗜黏蛋白阿克曼菌中的组合酶可高效去除A、B抗原,将血液转化为O型。其原理是通过糖苷酶切割抗原糖链中的关键糖基,例如将A抗原的N-乙酰半乳糖胺转化为H抗原(O型标志)。东南大学团队进一步优化了酶的结构,将转化效率提升至99%以上。目前技术仅能实现向O型血的单向转换,直接由A型转为B型尚无成功案例。

另一途径是造血干细胞移植。若患者接受异基因移植,其造血系统将完全被供者取代,血型也随之改变。例如,一名O型血白血病患者接受A型供体干细胞后,血型永久转为A型。但此方法仅适用于特定疾病治疗,无法作为常规血型转换手段。
二、遗传规律的例外与挑战
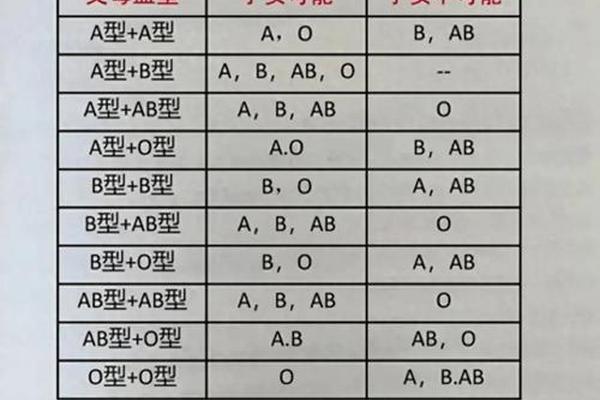
根据孟德尔遗传法则,两个B型血父母的基因型应为BB或BO,子代仅可能为B型(75%)或O型(25%)。现实中存在两类罕见遗传现象打破这一规律:孟买血型与顺式AB型。
孟买血型由H抗原缺失导致。此类个体的基因可能携带A或B等位基因,但因缺乏H抗原(A/B抗原的合成基础),其红细胞表面无法表达A/B抗原,常被误判为O型。若父母一方为孟买型(基因型为AB或BB),另一方为普通B型(基因型为BB或BO),子代可能继承隐性A基因并表达为AB型。例如,一名基因型为AB的孟买型父亲与B型母亲(BO)结合,子代可能为AB型。
顺式AB型则是A、B基因位于同一条染色体的特殊变异。此类个体的基因型为cisAB/O,其子代可能从父母各获得一个AB基因,形成AB型。2022年国内报道的案例中,一对B型血夫妇因父亲携带顺式AB基因,最终通过DNA亲子鉴定确认了孩子的AB型血缘。
三、技术应用的局限与争议
酶催化技术虽前景广阔,但面临多重挑战。抗原残留可能导致免疫排斥。研究显示,经酶处理的B型血转化为O型后,仍有4%的抗原未被清除,需进一步优化酶活性。红细胞寿命与功能可能受损。东南大学团队发现,转化后的红细胞存活率较天然O型血低15%,可能影响输血效果。
干细胞移植的血型转换则涉及风险。供者干细胞需严格匹配,且移植后患者需长期服用免疫抑制剂,增加感染与肿瘤风险。血型改变可能引发身份认同问题。例如,一名接受移植的患者曾因血型变更被质疑亲子关系,需通过基因检测澄清。
四、未来方向与科学启示
血型研究的核心目标是为临床提供安全血液资源。未来需从三方面突破:一是开发多价酶体系,实现A/B型向任意血型的可控转换;二是利用基因编辑技术(如CRISPR)直接修饰造血干细胞的血型基因;三是完善罕见血型的筛查体系,避免遗传误判。
对公众而言,需理性看待血型转换的可能性。尽管技术尚不成熟,但其在缓解血荒、器官移植等领域的潜力不可忽视。血型遗传的复杂性警示我们,DNA检测仍是亲子鉴定的金标准,传统血型推断仅具参考价值。
血型转换与遗传例外性揭示了生命科学的复杂性与创新性。酶工程的突破为血液供应开辟新途径,罕见遗传现象的发现则挑战了传统认知。未来,跨学科合作与技术迭代将推动这一领域迈向更高精度与安全性。对于公众,理解这些科学进展不仅有助于消除误解,更能促进对医学与技术边界的思考。血型之谜的探索,终将为人类健康带来更深远的福祉。


