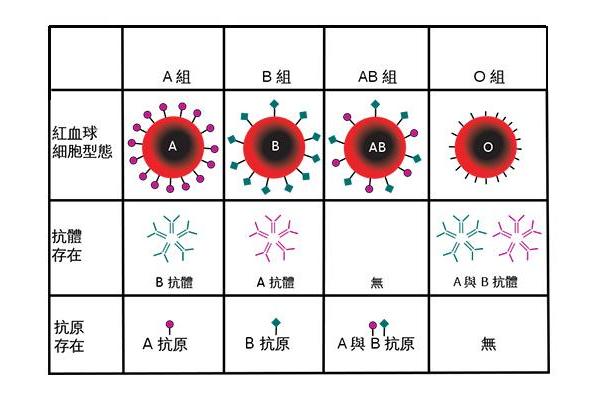
ABO血型系统是人类最早被发现且最具临床意义的血型系统,其核心在于红细胞表面A、B抗原的糖链结构差异。A抗原的末端糖基为N-乙酰半乳糖胺,B抗原则为半乳糖,而H抗原作为前体物质仅含岩藻糖。这种微小的化学差异决定了抗原的免疫特异性,并通过血清中的天然抗体(抗A或抗B)形成抗原-抗体反应的生物学基础。根据兰德施泰纳的发现,ABO血型的分型依据红细胞表面抗原与血清抗体的对应关系,例如A型个体血清中含抗B抗体,而AB型则无任何抗体。
从分子遗传学角度看,ABO基因位于9号染色体长臂(9q34),包含三个主要等位基因:IA、IB和i。IA基因编码α-1,3-N-乙酰半乳糖胺转移酶,IB基因编码α-1,3-半乳糖转移酶,而i基因因移码突变导致无功能。H抗原的形成则依赖于FUT1基因编码的岩藻糖转移酶,其缺失会导致孟买血型(Oh型),此时即使携带IA或IB基因也无法表达A/B抗原。这种遗传机制的复杂性解释了ABO血型在人群中的多样性分布,例如我国汉族人群中O型占比约27%,而AB型仅10%。
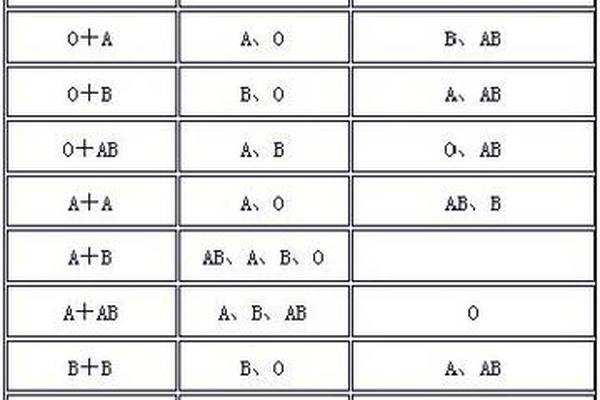
抗原-抗体反应的临床意义
ABO血型抗原与抗体的相互作用是输血医学的核心问题。天然抗体(IgM类)在出生后6-12个月内形成,通过环境微生物中类似糖链结构的刺激产生。当输入异型血液时,抗体与供体红细胞抗原结合会激活补体系统,引发急性溶血反应。例如,A型受血者若误输B型血,其血清中的抗B抗体将导致供体红细胞迅速溶解。输血前必须严格遵循交叉配血原则,O型血虽无A/B抗原,但其血清中的抗A和抗B抗体仍可能对非O型受血者造成风险。
在妊娠医学中,ABO血型不合可能引发新生儿溶血病(HDN)。据统计,母婴O-A血型不合的新生儿中,26.68%会出现溶血症状。与Rh系统不同,ABO溶血通常较轻,因胎儿红细胞的A/B抗原表达较弱,且母体IgG类抗体可通过胎盘的能力有限。当母亲为O型而胎儿为A/B型时,仍需通过脐带血检测胆红素水平及抗体效价进行早期诊断。
血型抗原的生物学扩展功能
近年研究发现,ABO抗原不仅局限于红细胞表面,还广泛表达于上皮细胞、血管内皮及分泌液中,并参与细胞黏附、病原体识别等生理过程。例如,胃黏膜细胞的A抗原可能影响幽门螺杆菌的定植,而O型个体因缺乏A/B抗原修饰,患胃癌风险相对较高。Lewis血型抗原(如Lea、Leb)与ABO系统存在代谢关联,其异常表达与肿瘤转移密切相关。癌患者唾液酸化Lewis抗原(CA19-9)的升高已成为临床重要标志物。
在免疫调控领域,唾液酸化Lewis-X(SLeX)作为选择素E的配体,介导淋巴细胞归巢和炎症反应。研究发现,小鼠胚胎发育过程中,Lex抗原通过调控钙离子依赖性细胞黏附参与胚胎紧密化过程。这些发现揭示了血型抗原在进化中的多重功能,提示其可能起源于病原体防御机制——特定糖链结构可模拟病原体表面抗原,诱导保护性抗体产生。
未来研究方向与技术挑战
尽管ABO血型系统已有百年研究历史,其分子调控机制仍存在未解之谜。例如,表观遗传学研究发现,ABO基因启动子区CpG岛的甲基化可能导致B抗原弱表达,这为解释血清学检测中的亚型现象提供了新思路。基因编辑技术的进步使得体外修饰红细胞血型成为可能,这对解决稀有血型短缺问题具有重要意义。
在临床检测技术层面,微柱凝胶法和自动化血型分析系统显著提高了检测灵敏度,但仍存在假阳性问题。未来需结合质谱技术和单细胞测序,实现对血型抗原表达的精准定量。血型抗原在肿瘤免疫治疗中的应用潜力也值得探索,例如利用抗Lewis抗体靶向肿瘤细胞。
ABO血型抗原体系不仅是输血安全的基石,更是连接遗传学、免疫学与疾病机制的桥梁。从糖链结构的细微差异到跨物种的进化保守性,从临床溶血反应到肿瘤标志物的转化应用,这一系统持续展现其科学价值。随着多组学技术的整合,未来有望揭示血型抗原在个体化医疗中的更深层作用,为精准输血、疾病预防及治疗开辟新路径。


