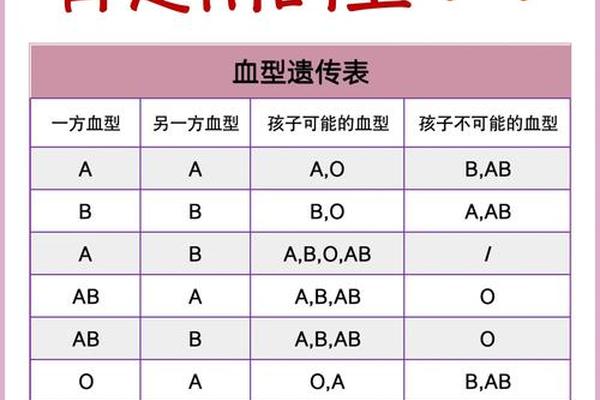
人类ABO血型系统的核心在于红细胞表面抗原与血清抗体的免疫学特性。A型血的红细胞携带A抗原,血浆中则含有抗B抗体。这种抗原-抗体的对应关系决定了输血相容性的基本逻辑:当供血者的红细胞抗原与受血者的血清抗体发生冲突时,会引发致命的溶血反应。例如,若将B型血输入A型患者体内,B型红细胞表面的B抗原会与A型血清中的抗B抗体结合,激活补体系统导致红细胞破裂。
从遗传学角度分析,ABO血型由9号染色体上的等位基因控制。A型血个体的基因型可能是AA或AO,其编码的糖基转移酶将N-乙酰半乳糖胺连接到H抗原末端形成A抗原。这种分子结构的特异性不仅影响着输血安全,还与器官移植配型、疾病易感性等医学领域密切相关。研究发现,某些白血病患者可能出现A抗原表达减弱的亚型变异,此时常规血型鉴定可能产生误差,需通过分子生物学检测确认。
同型输血的核心原则
在临床实践中,A型患者输血的首选方案始终是同型血液输注。这种原则的确立源于百年输血医学的经验教训——1912年法国医生卡雷尔因血管吻合术获得诺贝尔奖后,输血技术虽获推广,但因缺乏血型知识导致的死亡率仍高达30%。直到1930年兰德施泰纳明确ABO血型规律,同型输血才成为黄金标准。现代数据显示,严格执行同型输注可使输血相关死亡率降低至0.003%以下。
同型输血的必要性体现在多重维度:A型血浆中的抗B抗体浓度高达1:64至1:256,即使微量异型红细胞进入也会触发免疫应答。血小板表面同样携带ABO抗原,异型血小板输注会缩短其存活周期。更关键的是,约15%的A型人群携带不规则抗体,这些隐匿的免疫因子可能对非自体抗原产生迟发性溶血反应。《临床输血技术规范》明确要求,除战地急救等极端情况外,必须遵循ABO同型输注原则。
O型血的特殊应用场景
O型血被称为“万能供血者”的说法需要辩证看待。其红细胞缺乏A、B抗原的特性确实在紧急救治中具有特殊价值,例如创伤大出血患者未完成血型鉴定前,可暂时输注O型悬浮红细胞维持组织供氧。但这种应急方案存在严格限制:单次输注量不得超过400ml,且必须使用抗体效价低于1:200的O型洗涤红细胞,以降低血浆中抗A抗体引发的溶血风险。
值得注意的是,O型全血并非真正“万能”。其血浆中含有的抗A、抗B抗体若大量输入A型患者体内,会与受体红细胞发生反应。1940年代英国皇家医院的案例显示,输注800ml O型全血导致A型患者出现血红蛋白尿和急性肾损伤。因此现代输血指南强调,O型血仅作为红细胞成分的临时替代品,且需在输注后72小时内置换为同型血液。
Rh血型系统的叠加影响
在ABO血型相容的基础上,RhD抗原的匹配同样关键。我国汉族人群中Rh阴性比例不足1%,这类“熊猫血”患者若接受Rh阳性血液,60%会产生抗D抗体,导致再次输血时发生严重溶血。对于A型Rh阴性患者,输血策略需双重考量:既要保证ABO同型,又需RhD抗原阴性。特殊情况下可采用自体输血技术,术前分次采集患者血液,经处理后术中回输,既避免异体免疫反应,又缓解血源短缺压力。
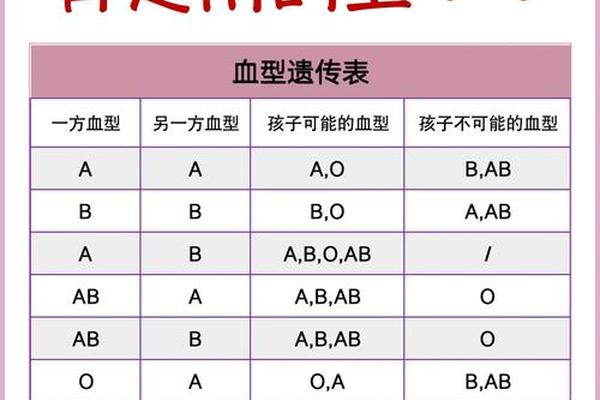
Rh血型的复杂性还体现在亚型检测上。2019年宁夏血液中心接诊的B3亚型孕妇案例显示,使用常规血清学方法可能误判血型,需结合PCR-SSP基因分型技术才能准确鉴定。这提示未来输血医学需向分子诊断层面发展,通过基因测序预判输血风险,特别是对多次输血可能产生抗体的高危人群。
交叉配血的终极防线
即便满足ABO和Rh血型相容,临床输血前仍需完成交叉配血试验。该检测包含主侧(供者红细胞+受者血清)和次侧(受者红细胞+供者血清)双重验证,可发现99.8%以上的潜在不相容。2022年某三甲医院数据显示,在1256例ABO同型输血中,仍有3例因不规则抗体导致配血失败,最终通过抗体筛查调整为特定供体。这印证了《输血相容性检测指南》的核心观点:血型匹配只是输血安全的第一道关卡,免疫相容性才是终极评判标准。
现代交叉配血技术已发展至分子水平。流式细胞术能检测微量抗体,微柱凝胶法可提高凝集反应灵敏度,而基因芯片技术可同时筛查300种血型抗原。这些技术进步大幅提升了临床用血安全,使输血相关急性肺损伤(TRALI)发生率从2000年的1/5000降低至如今的1/12000。
A型血的输血安全建立在ABO同型优先、O型应急限用、Rh系统共检、交叉配血兜底的四重保障体系之上。随着精准医学的发展,输血策略正从群体化向个体化演进:基因编辑技术有望制备通用型红细胞,质谱分析可实时监测输血免疫反应,而人造血液的研究将突破血型限制。建议医疗机构建立患者血型分子档案库,对需长期输血者进行HLA配型和抗体谱分析,通过智能化血库管理系统实现精准配血。未来的输血医学,将在保障安全性的向高效化、个性化方向持续迈进。