在医学检验与输血实践中,ABO血型系统的鉴定是保障临床安全的核心环节。当我们在实验室中通过“正反定型”方法确认某个体为A型血时,这一结论背后既包含了抗原抗体反应的生物学规律,也可能隐藏着亚型干扰或技术误差的挑战。例如,当使用标准抗A血清和O型红细胞进行正反定型时,A型血个体的红细胞应呈现A抗原阳性反应,而血清中应存在抗B抗体。这一看似简单的逻辑链条,实则涉及遗传学、免疫学与分子生物学的多重验证。
血型分型的生物学机制
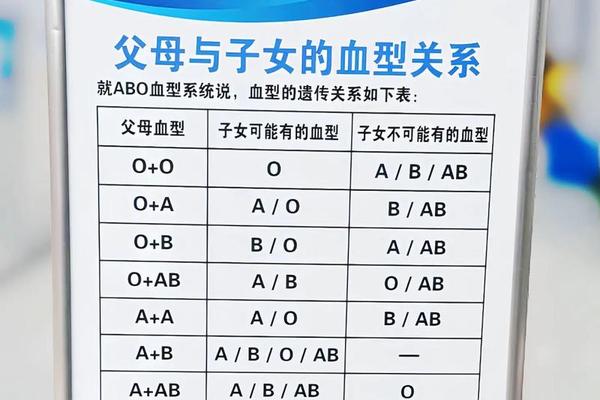
ABO血型系统的分型基础源于红细胞表面抗原的差异。根据兰茨泰纳于1900年提出的理论,A型血的红细胞表面携带A抗原,血清中含有抗B抗体;B型血则相反;AB型同时具有A、B抗原而无对应抗体;O型缺乏A、B抗原但含有抗A和抗B抗体。这种抗原-抗体互补关系构成了血型鉴定的核心逻辑。
现代研究发现,A抗原的分子本质是糖基转移酶催化产生的N-乙酰半乳糖胺结构,其编码基因位于第9号染色体。当个体携带显性A等位基因时,红细胞表面会表达A抗原。值得注意的是,A型存在A1、A2等亚型,其中A2型的抗原表达强度仅为A1型的1/4-1/3,这可能导致常规血清学检测出现弱凝集反应。在正定型过程中加入O型血清(含抗A、抗B抗体)可增强对弱抗原的识别,避免将A2型误判为O型。
正反定型技术的实践挑战
临床常用的玻片法与试管法均遵循抗原抗体特异性结合原理。以A型血鉴定为例:正定型需用抗A试剂与待检红细胞反应,出现凝集则提示A抗原存在;反定型则需用B型试剂红细胞与待检血清反应,凝集表明血清含抗B抗体。双重验证机制理论上可确保结果的准确性,但在实际检测中仍面临多重挑战。
当遇到ABO亚型时,常规方法可能失效。例如CisAB型个体的A、B基因位于同一条染色体,其红细胞同时表达弱化A、B抗原,血清中却可能残留抗A或抗B抗体,导致正反定型矛盾。此时需借助分子检测技术,通过分析ABO基因外显子序列来确认血型。新生儿因抗体发育不全、老年人因抗体水平下降等情况也会干扰反定型结果,需结合基因检测补充验证。
特殊血型的鉴别诊断
在血型鉴定中,约0.1%的案例存在正反定型不符的情况。以孟买型为例,这类个体因FUT1基因突变导致H抗原缺失,其红细胞不表达A、B抗原,但血清中含有抗H抗体,常规检测易误判为O型。此时若辅以抗H血清检测,可发现其红细胞与抗H试剂不凝集,从而揭示真实血型。
另一个典型案例是顺式AB型(CisAB)。这类血型的遗传特征打破了常规的显隐规律,当父母分别为O型和AB型时,子女可能呈现AB型或O型,直接冲击传统的亲子鉴定逻辑。基因测序显示,CisAB型的形成源于ABO基因的罕见重组事件,其酶学活性同时具备A、B转移酶功能,但抗原表达强度显著低于普通AB型。
技术创新与未来方向
随着分子生物学的发展,血型鉴定已从血清学层面深入到基因层面。PCR-SSP、基因芯片等技术可精准识别ABO基因的SNP位点,对A205、A210等稀有等位基因的分辨率达到99.9%。我国深圳血液中心研发的同步基因分型试剂盒,可同时检测A101、A102等12种常见等位基因,将亚型误判率降至0.01%以下。
在输血安全领域,自体血液冷冻保存技术的突破为稀有血型患者带来新希望。采用甘油化冷冻法可使红细胞保存期延长至10年,解冻后存活率超过90%。而人工血液的研发进展更令人振奋,基于血红蛋白氧载体的代用品已完成III期临床试验,其输注后24小时循环存活率达97%,为彻底解决血型匹配难题提供了可能。
ABO血型系统的鉴定既是基础医学的重要课题,也是临床安全的生命防线。通过正反定型确认A型血的过程,本质上是对遗传信息与免疫反应的双重验证。面对亚型干扰、技术局限等挑战,融合血清学、基因组学与低温生物学的综合检测体系正在形成。未来研究应着重于三方面:一是建立中国人群ABO基因多态性数据库,二是开发快速精准的床旁检测设备,三是完善稀有血型互助网络。唯有如此,才能让每个血型标识背后的个体都获得平等的生命保障。


