1900年,奥地利学者卡尔·兰德施泰纳首次通过实验观察到不同个体的血清与红细胞混合后会发生凝集现象,由此揭开了人类ABO血型系统的神秘面纱。这一发现不仅为安全输血奠定了基础,更揭示了人体内天然存在的血型抗体对生命活动的重要影响。在ABO系统中,A型血个体的红细胞表面携带A抗原,其血浆中则规律性存在抗B抗体,这种抗体的存在遵循Landsteiner法则——即血液中不会产生针对自身抗原的抗体。
天然ABO血型抗体作为免疫系统的重要组成部分,其本质是IgM型免疫球蛋白。这类抗体在无明确抗原刺激的情况下自然存在于血液中,与通过免疫途径产生的IgG型抗体形成鲜明对比。从分子结构来看,IgM是由五个单体通过J链连接而成的五聚体,其分子量高达900kDa,这种庞大的结构使其无法通过胎盘屏障,但也赋予其强大的补体激活能力。
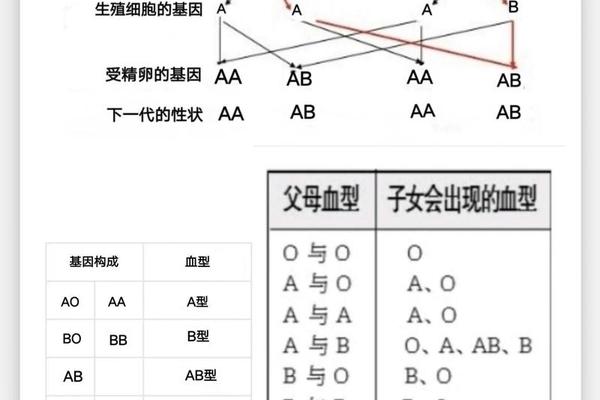
天然抗体的形成机制
天然ABO抗体的产生机制长期困扰着医学界。现代研究表明,这种看似"与生俱来"的抗体,实际上源于人体与自然界的持续互动。环境中广泛存在的微生物(如大肠杆菌、肺炎链球菌等)表面含有与A/B抗原相似的糖链结构,这些微生物抗原持续刺激免疫系统,诱导B淋巴细胞产生交叉反应性抗体。以A型血个体为例,其肠道菌群中缺乏A型抗原类似物,而B型抗原类似物持续存在,导致免疫系统将B型抗原识别为"非我"物质,从而生成抗B抗体。
胎儿在出生时尚未形成完整的ABO抗体系统,但在出生后3-6个月内,随着肠道菌群的定植和环境抗原的暴露,抗体效价迅速升高至成人水平。这种发育过程具有显著的地域差异性,热带地区儿童因接触更多微生物抗原,其抗体效价往往高于温带地区儿童。值得注意的是,天然抗体并非完全静态存在,研究发现老年人群中IgM型抗体的效价会随年龄增长逐渐下降,这可能与免疫系统衰老导致的抗体多样性减少有关。
免疫抗体的特殊属性
与天然抗体不同,免疫性ABO抗体属于IgG型,这类抗体通常由异体红细胞抗原刺激产生。O型血母亲体内可能同时存在IgM和IgG两种抗A/B抗体,当IgG型抗体通过胎盘进入胎儿循环时,可能引发新生儿溶血病。IgG的分子结构(单体,150kDa)使其具备胎盘穿透能力,其Fc段可与巨噬细胞表面的Fc受体结合,导致红细胞被吞噬破坏,这种机制是ABO溶血病的主要病理基础。
在输血医学实践中,IgM与IgG的生物学特性差异直接影响临床决策。IgM型天然抗体在4-25℃环境下活性最强,能直接引起红细胞凝集,因此ABO血型不合的输血会引发急性血管内溶血。而IgG型免疫抗体需要抗球蛋白试剂才能检测,其引起的迟发性溶血反应更具隐匿性,可能发生在输血后5-10天。这种差异解释了为何ABO血型系统的抗体筛查需要同时进行盐水介质和抗球蛋白试验。
临床实践中的双重影响
在产科领域,约15-25%的妊娠存在ABO血型不合,但仅1%会导致临床可识别的新生儿溶血病。这与IgM抗体无法通过胎盘的特性密切相关,当母体为O型而胎儿为A/B型时,若母体仅存在IgM型抗体则不会引发溶血。但对于曾接受过异型输血或干细胞移植的个体,其体内可能同时存在IgM和IgG型抗体,这类患者需要更精细的抗体效价监测和免疫调节治疗。
现代输血医学通过分子检测技术发现,ABO抗体多样性远超传统认知。约5%的A型人群携带IgG2亚型抗B抗体,这类抗体无法激活补体系统,导致常规交叉配血试验可能出现假阴性结果。这促使临床采用更灵敏的固相凝集技术,以及基因测序手段来精确判断抗体的生物学特性。对于器官移植领域,供受体ABO抗体相容性评估已从单纯的IgM检测发展到IgG亚型定量分析,显著降低了超急性排斥反应发生率。

未来研究方向与挑战
随着单细胞测序技术的进步,研究者正在绘制天然抗体的发育轨迹图谱。2023年《自然·免疫学》刊文指出,人类肠道共生菌中的拟杆菌属可能通过分子模拟机制影响ABO抗体的表位识别特性,这为调控抗体反应提供了新思路。在临床转化方面,开发可特异性中和IgG型抗体的纳米吸附剂,已成为预防重度新生儿溶血病的研究热点,动物实验显示该技术可使抗体效价降低80%。
针对ABO抗体多样性的精准检测仍存在技术瓶颈。现有商业化试剂盒仅能区分IgM/IgG类别,对IgG亚型的识别率不足60%。建立基于质谱流式细胞术的抗体表型数据库,结合人工智能预测模型,可能在未来十年内实现抗体特性的全景解析。这些突破不仅将提升输血安全性,更可能为自身免疫性疾病的治疗开辟新途径。
通过多维度解析ABO血型抗体的生物学特性与临床意义,我们深刻认识到这类天然存在的免疫分子既是生命保护屏障,也可能成为健康威胁。从兰德施泰纳的凝集实验到现代分子免疫学研究,人类对ABO抗体的认知突破始终推动着临床实践革新。未来需要整合组学技术、计算生物学和临床大数据,建立更完善的抗体风险评估体系,最终实现个体化医疗在输血医学和围产医学中的全面应用。


