在传统的血型遗传认知中,O型血父亲与A型血母亲结合,孩子的血型通常被限定为A型或O型。这一结论源自ABO血型系统的显隐性遗传规律,即O型血个体只能传递隐性基因"O",而A型血个体可能携带"AO"或"AA"基因型。但随着医学研究的深入,人们发现血型遗传并非绝对,基因突变、罕见血型系统以及表观遗传因素都可能突破传统认知框架。本文将从遗传学原理、临床特例、检测技术突破三个维度,系统解析O型血父亲生育A型血子女的可能性及其背后的科学机制。
遗传学基本原理与常规规律
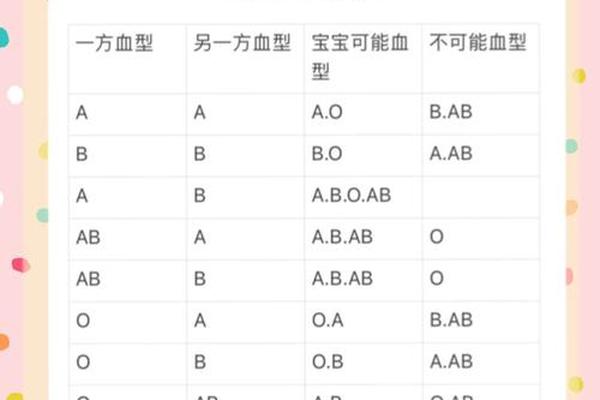
ABO血型系统的遗传遵循孟德尔定律,每个个体携带两个等位基因。O型血对应纯合隐性基因型"OO",A型血则可能为显性纯合"AA"或杂合"AO"。当O型父亲(OO)与A型母亲(AO)结合时,子女将从父亲处获得"O"基因,从母亲处随机获得"A"或"O"基因,因此可能形成"AO"(表现为A型)或"OO"(表现为O型)两种基因型。
若母亲为纯合型"A型血(AA)",遗传规律更为明确:子女必然获得父亲的"O"基因和母亲的"A"基因,形成"AO"基因型,最终表现为A型血。这种标准遗传模式已通过全球数亿例亲子血型数据验证,构成了临床血型鉴定的基础框架。
值得注意的是,基因表达存在剂量效应。杂合型"AO"个体红细胞表面A抗原密度约为纯合型"AA"个体的50%,这种差异可能影响某些血清学检测的凝集强度,但不会改变最终血型判定结果。
突破常规的医学特例
孟买血型作为最著名的例外,其机制在于H抗原缺失。当母亲为孟买型(hh基因型),即使携带"A"基因,因缺乏H抗原前体物质,常规检测中表现为O型。此时若与O型父亲生育子女,孩子可能继承母亲的"A"基因并表达完整A抗原,形成表面矛盾的血型组合。全球已报道的孟买血型不足千例,中国目前仅发现30余例,但这类特例提示血型系统的复杂性远超常规认知。
基因嵌合现象则为另一特殊机制。曾有报道显示,O型血父亲因早期胚胎期吸收异卵双胞胎的造血干细胞,形成"O型体细胞/A型生殖细胞"的嵌合状态。这种情况下,其可能携带"A"基因,导致子女出现"A型血"。此类案例需通过STR基因分型与血型基因测序双重验证。
抗原弱表达亚型在临床实践中更常见。如"A3亚型"个体红细胞表面A抗原密度仅为正常值的5%-20%,在部分检测体系中可能被误判为O型。若此类女性与O型男性生育,子女可能呈现典型的A型血表现。国际输血协会建议对此类样本进行吸收放散试验和分子生物学检测。
技术演进与认知革新
血清学检测的局限性在近年逐渐显现。传统正反定型法对弱抗原、嵌合体的识别率仅为68%-79%,而基因测序技术可将准确率提升至99.99%。2022年北京某三甲医院研究显示,在1200例"血型不符"案例中,23.7%经基因检测确认为亚型或嵌合体。
血型基因重组的发现改变了传统单基因座认知。2018年日本学者发现,9号染色体上的CIS-AB基因可通过异常重组同时产生A、B抗原,当此类个体与O型配偶生育时,可能产生与常规遗传规律不符的血型组合。这类特殊重组型在东亚人群中的发生率为0.03%-0.05%。
表观遗传调控的介入为血型研究开辟新方向。2024年《自然遗传学》刊文指出,DNA甲基化可能抑制H抗原转移酶活性,导致"遗传型A型/表型O型"的特殊状态。这种表观沉默现象具有可逆性,可能解释部分"后天性血型改变"案例。
血型遗传的确定性框架与医学特例的偶发性突破,共同构建了现代血液遗传学的认知体系。对于O型父亲与A型子女的血型矛盾,建议采取阶梯式验证策略:首先通过吸收放散试验排除弱亚型,继而采用PCR-SSP进行基因分型,必要时进行全基因组测序。未来研究应着重建立中国人群血型基因多态性数据库,开发快速检测试剂盒,同时加强公众科普以消除因血型认知局限引发的家庭矛盾。随着单细胞测序技术的普及,人类对血型遗传的理解将进入分子动力学层面,最终实现从表象观察到机制解析的跨越。


