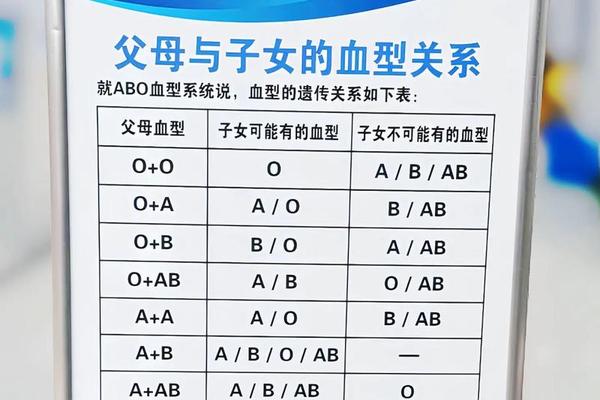
在人类基因的复杂图谱中,ABO血型系统以其独特的显隐性遗传规律,构建起生命最初的生物学身份标识。当O型血与A型血的个体结合时,这种看似简单的基因互动,实则蕴含着精妙的生命密码。根据孟德尔遗传定律,父母双方各贡献一个等位基因,通过基因重组形成子代的血型特征。大量研究表明,O型血(ii基因型)与A型血(AA/AO基因型)的结合,其子代血型分布遵循特定的遗传规律。这种规律不仅关乎生物学身份确认,更与新生儿健康风险密切相关。
遗传机制解析
A型血个体的基因型存在两种可能:显性纯合(AA)或显性杂合(AO)。而O型血作为隐性纯合体(ii),仅能传递隐性i基因。当A型(AO)与O型(ii)结合时,子代有50%概率获得A基因形成AO型(表现为A型血),50%概率获得两个i基因形成O型血。若A型父母为显性纯合(AA),则所有子代都将继承A基因,表现为A型血。
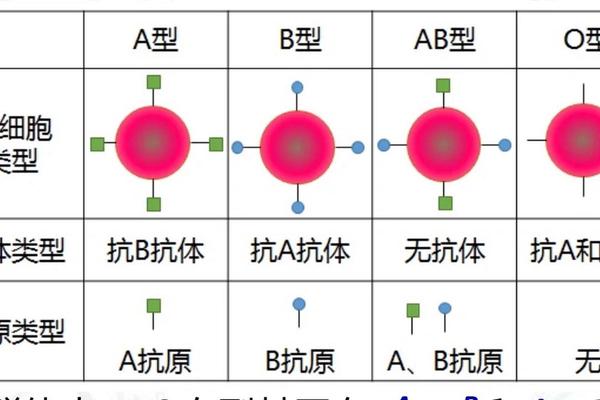
这种遗传机制的基础在于红细胞表面抗原的合成过程。A抗原的形成需要N-乙酰半乳糖胺转移酶的催化作用,而O型血个体因缺乏该酶活性,无法生成A/B抗原。值得注意的是,基因测序技术的发展揭示了约0.01%的AB亚型存在,这类特殊基因型可能导致常规血清学检测的误判,这也是临床上偶见"违反"遗传规律案例的生物学基础。
新生儿溶血风险
当O型血母亲怀有A型胎儿时,母体免疫系统可能将胎儿红细胞表面的A抗原识别为异物,产生IgG型抗A抗体。这种抗体能够穿透胎盘屏障,导致胎儿红细胞破坏,引发新生儿溶血病(HDN)。临床数据显示,约20%的O型血孕妇会产生具有临床意义的抗体,但实际发生中重度溶血的概率仅为0.3%-2.5%。
溶血风险的监测主要依靠抗体效价检测和超声多普勒检查。当抗体效价≥1:64时,需启动干预措施,包括静脉注射免疫球蛋白、光照疗法等。值得注意的是,首胎妊娠同样存在溶血风险,这与孕前输血、流产史等因素导致的致敏过程密切相关。近年研究发现,胎盘屏障的通透性存在个体差异,约15%孕妇的胎盘允许IgM抗体通过,这为预测溶血风险提供了新的生物标记研究方向。
特殊遗传现象探秘
在常规遗传规律之外,某些特殊基因型挑战着传统认知。孟买血型个体因缺乏H抗原前体物质,即便携带A/B基因也不会表达相应抗原,这类人群与A型血结合可能产生表型"异常"的子代。基因测序曾发现0.002%的Cis-AB重组基因型,这种基因突变可使单条染色体同时携带A、B基因,导致子代血型出现"超常规"分布。
2023年《新英格兰医学杂志》报道的特殊案例显示,某A型血母亲实为ABw亚型携带者(A102/Bw11基因型),其与O型丈夫生育的B型血子女,经基因测序证实为Bw11/O01基因型。这类案例提示,常规血清学检测在罕见血型识别中存在局限性,二代测序技术(NGS)的应用将临床血型鉴定准确率提升至99.99%。
医学实践启示
在临床输血医学中,O型血并非绝对"万能供血者"。最新《临床输血技术规范》强调,O型全血输注给非O型患者时,必须进行抗体筛查和交叉配血试验。对于存在溶血风险的孕妇,建议在孕16周开始每月进行抗体筛查,并结合胎儿大脑中动脉血流峰值速度(MCA-PSV)进行动态监测。
基因编辑技术的突破为预防新生儿溶血提供了新思路。2024年上海交通大学团队利用CRISPR-Cas9技术,成功修饰母体B淋巴细胞中的抗体编码基因,在灵长类动物实验中使抗A抗体效价降低83%。虽然该技术尚未进入临床阶段,但为未来根治新生儿溶血病指明了方向。
O型与A型血的遗传组合,既展现了生命密码的精妙,也揭示了医学实践的复杂性。从基础遗传规律到特殊基因现象,从溶血风险防控到基因治疗探索,这个看似简单的血型组合蕴含着丰富的科学内涵。随着单细胞测序技术和基因编辑技术的发展,我们有望在分子层面实现更精准的遗传预测和干预。建议育龄夫妇在孕前进行扩展血型基因检测,医疗机构建立罕见血型基因数据库,共同构建更完善的新生儿健康保障体系。未来的研究应聚焦于胎盘屏障调控机制、基因修饰技术等前沿领域,为人类生殖健康开辟新的可能性。


