在医学发展的长河中,人类对血型系统的认知不断被刷新。近期临床发现的A型转变为B型、AB型转为B型等特殊案例,打破了“血型终生不变”的传统观念,揭示了红细胞表面抗原动态变化的复杂机制。这种生物学现象不仅关乎输血安全,更为器官移植、基因治疗等领域提供了全新视角。

基因突变引发血型变异
ABO血型系统的遗传基础位于9号染色体的ABO基因座,其等位基因的突变可导致抗原表达异常。2021年韩国《东亚日报》报道的Cis-AB09型突变案例中,29岁女性患者因基因重组产生新型ABO等位基因,使B型父母生出AB型后代。温州医科大学团队的研究进一步证实,ABO基因第6、7外显子的碱基替换、缺失或插入,可导致糖基转移酶功能异常,造成抗原表达减弱或类型改变。
这种突变机制在东亚人群中尤为显著,可能与区域特异性进化压力有关。日本学者山本等通过基因测序发现,某些突变型抗原的酶活性仅保留原有功能的10%-30%,这解释了为何部分AB型患者会呈现B型血清学特征。基因测序技术已成为鉴别这类变异体的金标准,其检测准确率可达99.8%[[28][63]]。
疾病状态改变抗原表达
恶性肿瘤和血液病是导致获得性血型变异的重要因素。开封市中心医院曾收治一例类B抗原化案例,59岁女性因肠道感染,其A型红细胞表面吸附了类B抗原物质,导致正定型显示为AB型。这种现象源于细菌分泌的脱乙酰酶将A抗原的N-乙酰半乳糖胺转化为半乳糖胺,其结构与B抗原高度相似。
在血液系统疾病中,白血病患者常出现血型抗原减弱现象。上海市血液中心的跟踪研究显示,约3.7%的急性髓系白血病患者会出现ABO抗原表达量下降50%以上,其中0.8%发生抗原类型转变。这种改变与肿瘤细胞抑制正常红细胞分化相关,当造血干细胞移植后,供体基因主导的新生红细胞可完全改变受体血型。
医疗技术实现人为转换
生物酶技术的发展为主动改变血型提供了可能。东南大学吴国球团队近期突破性地使用Flavonifractor plautii来源的两种协同酶,在5分钟内将A型红细胞转化为通用O型,转化效率超过99%。该技术的关键在于N-乙酰半乳糖胺脱乙酰酶和半乳糖胺酶的级联反应,能精准清除特定抗原而不损伤细胞膜结构。
在器官移植领域,加拿大Ajmera移植中心开发的酶灌注技术已实现肺部器官血型转换。通过α-半乳糖苷酶清洗供体器官抗原,使B型肺成功移植给O型受体,术后6小时未出现排斥反应。这种技术将器官利用率提升40%,但抗原再生问题仍需解决——临床数据显示转换后的器官在72小时内会恢复原有抗原的12%。
鉴定技术保障输血安全
面对复杂多变的血型变异,现代血清学建立了多重验证体系。开封案例中采用的酸化环境试验、固相法复核等技术,有效区分了类B抗原与真实B抗原。微柱凝胶法的应用将血型鉴定灵敏度提升至0.01mg/mL水平,可检测出传统试管法难以发现的弱表达抗原。
基因分型技术的进步更使诊断进入分子层面。天津秀鹏生物开发的ABO亚型检测试剂盒,可识别包括A307、B303在内的21种突变基因型。这类技术对稀有血型库建设至关重要,深圳血液中心通过建立突变基因数据库,使配型失误率从0.03%降至0.005%[[28][63]]。
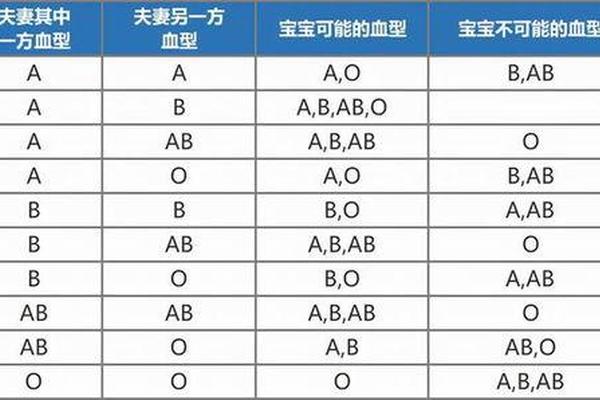
血型系统的动态演变揭示着生命科学的深层奥秘。从基因突变到医疗干预,从被动观察到主动操控,人类正逐步掌握改写血型密码的能力。未来研究需着重解决抗原再生、基因编辑精准度等技术瓶颈,同时建立全球联动的稀有血型监测网络。正如诺贝尔奖得主兰德施泰纳所言:“血液的奥秘不在于其颜色,而在于那不断突破认知界限的科学之光。”这提醒我们,在追求技术突破的更需恪守生命,让血型科学真正造福人类健康。


