1227A DEL血型是亚洲人群中常见的RhD变异类型,其核心特征在于RHD基因的1227位点发生G>A突变(即RHD 1227A等位基因)。该突变位于RHD基因第9外显子与第9内含子的剪接位点,虽然未改变第409位氨基酸(K409K),但导致mRNA剪接异常,使得红细胞表面D抗原表达量极低(通常<30个抗原/细胞),常规血清学检测可能呈现假阴性,需通过吸收放散试验或分子生物学方法确认。研究表明,这种突变是东亚人群DEL表型的主要遗传基础,占中国DEL个体的95%以上,与欧洲人群中多等位基因型DEL形成鲜明对比。
从分子结构来看,RHD基因与RHCE基因在1号染色体短臂上呈反向排列,其外显子重组或碱基突变可能导致D抗原表达异常。1227A突变属于剪接点变异,直接影响基因转录后的mRNA稳定性,进而减少功能性RhD蛋白的合成。该突变与Ce抗原表型高度关联,携带者常表现为Ccee或Ccee表型,这提示其可能与RHCE基因的单倍型存在连锁遗传现象。
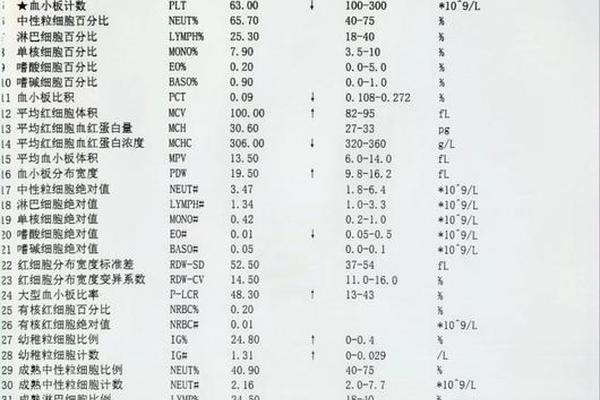
临床检测挑战与意义
常规血清学检测中,1227A DEL血型易被误判为RhD阴性,导致临床输血策略的潜在风险。数据显示,中国RhD阴性人群中约28.1%实际为DEL型,若未经过分子检测直接输注RhD阴性血液,可能造成稀有血型资源的浪费。更严重的是,DEL型个体接受RhD阳性血液后仍有免疫致敏风险,日本学者曾报道DEL型孕妇因未接受抗D免疫球蛋白预防而引发新生儿溶血病的案例。
分子检测技术的应用成为解决这一问题的关键。PCR-SSP(序列特异性引物PCR)和熔解曲线分析法已被证实可准确识别RHD 1227A突变,其检测灵敏度达99.8%。例如,大连地区对152例RhD阴性孕妇的基因分型显示,19例为RHD 1227A纯合型,且均表现为Ccee表型,这为制定精准的产前干预方案提供了依据。但需注意,目前检测标准尚未统一,部分实验室仍依赖血清学吸收放散试验,存在操作复杂、耗时长等局限性。
群体分布与遗传特征
亚洲人群中DEL血型的分布呈现显著地域特征。中国汉族人群DEL型发生率约为0.3%-0.5%,但在RhD阴性群体中占比高达35%-40%,其中长江流域省份尤为突出。基因频率分析显示,RHD 1227A等位基因在相对D阴性人群中的频率为0.1716,而在整体人群中仅0.0091,表明该突变与RhD阴性表型存在强相关性。值得注意的是,这类个体通常携带完整的RHD基因框架,仅因剪接异常导致抗原低表达,这不同于完全缺失RHD基因的经典RhD阴性。
家系研究揭示了该突变的显性遗传模式。父母若一方为DEL型,子女有50%概率遗传该等位基因;若双方均为DEL型,则子代可能表现为DEL型或真实RhD阴性。这种遗传特性使得DEL型成为亚洲Rh血型系统复杂性的典型代表,也解释了为何中国某些地区RhD"阴性"孕妇中高达22.5%实际为DEL型。
未来研究方向展望
当前研究亟待突破三大领域:需建立DEL型抗原的定量检测标准,明确不同D抗原阈值对应的临床风险等级。针对RHD 1227A等位基因的功能研究仍需深入,特别是其与RHCE基因单倍型的相互作用机制。开发快速、经济的床旁基因检测设备成为迫切需求,中国学者已尝试将熔解曲线分析法检测时间缩短至2小时,准确率达98.7%。
在临床实践层面,建议修订RhD阴性诊断标准,将分子检测纳入常规流程。对于DEL型个体,应制定差异化的输血策略——若作为供者,其血液可安全用于RhD阳性患者;若作为受者,则需按RhD阴性处理以避免同种免疫。公共卫生层面,建立DEL型专属血库和基因数据库,将有效提升稀有血型资源的利用效率。
本文系统阐释了1227A DEL血型的分子机制、检测挑战及临床价值,揭示了其在亚洲人群中的特殊遗传地位。随着精准医学的发展,对该血型的深入研究不仅优化了输血安全体系,更为探索Rh血型系统的进化提供了独特视角。未来需加强多中心协作,推动检测技术的标准化,最终实现个体化血液管理的目标。


