在医学领域,血型系统的复杂性与临床安全密切相关。近年来,关于血型转换技术的研究进展引发了广泛关注,例如通过酶处理将A型或B型血转化为“通用”O型血的尝试。当探讨O型血通过技术手段转变为携带A抗原的“AO型”后,其与A型血之间的相容性问题成为关键。这种人为干预的血型改变是否会导致溶血反应?其背后的免疫学机制如何?这些问题不仅涉及输血安全,还与器官移植、新生儿溶血病等临床场景息息相关。
ABO血型系统与抗原抗体反应
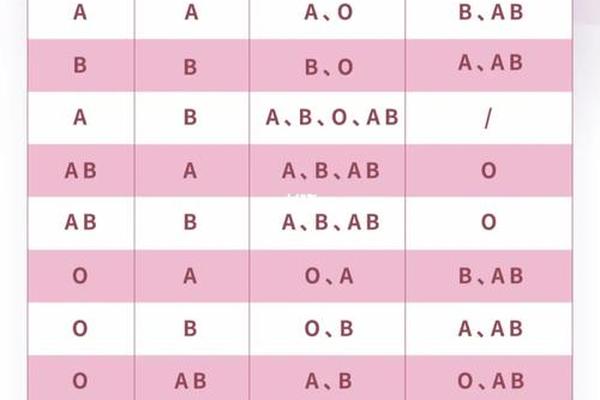
ABO血型系统由红细胞表面的A、B抗原决定,O型血的红细胞缺乏A和B抗原,但血清中含有抗A和抗B的IgM抗体。当O型血个体的血液与A型血接触时,其抗A抗体会识别A抗原并引发抗原-抗体反应,导致红细胞凝集和溶血。这种反应在异型输血中尤为危险,因此临床严格遵循同型输血原则。
值得注意的是,血型转换技术通过酶解法去除红细胞表面的A或B抗原,使其暂时呈现O型特征。但若技术不完全,残留的A抗原可能使“转化O型血”实质上成为携带微量A抗原的“AO型”,此时输入A型血受者体内,可能因受者血清中的抗A抗体与供者红细胞残留抗原结合而引发溶血。加拿大阿杰梅拉移植中心的研究显示,经酶处理的肺器官中97%的A抗原被清除后仍可能引发排异反应,说明微量抗原残留足以激活免疫应答。
O型血向AO型血的转化可能性
血型转换的核心在于抗原的精准清除。2025年东南大学吴国球团队的研究发现,利用肠道细菌Flavonifractor plautii的两种协同酶,可在4小时内将A型血红细胞表面97%的A抗原转化为O型特征。但这种转化具有暂时性,约一周后红细胞会重新表达部分A抗原,此时若将其误作O型血输注给A型患者,可能因受者血清中的补体系统攻击残留抗原而导致迟发性溶血。
另一种自然转化可能源于基因突变。例如罕见的顺式AB型血,其A和B基因位于同一条染色体,导致子代出现“违反”常规遗传规律的血型。若O型血个体发生类似突变,可能使红细胞表达弱A抗原,形成“AO型”。日本学者山本的研究指出,ABO基因外显子的微小变异即可改变抗原表达强度,这种变异可能使传统血型检测出现误差,增加输血风险。
溶血反应的临床场景与机制
在输血场景中,真正的O型血含有抗A和抗B抗体,输入A型血受者时,受者红细胞的A抗原会与供者血浆中的抗A抗体结合。研究显示,超过200ml异型输血即可引发显著溶血反应,表现为血红蛋白尿、急性肾衰竭等。而“AO型血”若残留A抗原,其血清中可能同时存在抗A抗体,形成自身抗体攻击残留抗原的“自我溶血”现象,这种双重风险使临床输血安全面临更大挑战。
母婴溶血则是另一重要场景。当母亲为O型血,胎儿遗传父亲A型血时,母体产生的IgG型抗A抗体可通过胎盘,导致新生儿溶血。若通过基因编辑使胎儿红细胞呈现“AO型”,理论上会加剧溶血风险,因为弱A抗原仍可被母体抗体识别。郑州大学第三附属医院的临床数据显示,85%的新生儿溶血病例由ABO血型不合引起,其中母O型-子A型组合占比最高。
医学实践的挑战与应对策略
当前血型检测技术对弱抗原的识别存在局限。青岛血液中心的专利研究显示,ABO基因单核苷酸多态性(SNP)可能导致血型误判,例如某些A亚型(如A3型)在常规血清学检测中易被误认为O型。对于转化后的“AO型血”,需采用分子生物学方法确认抗原清除程度,如PCR-SSP或基因测序。
在临床决策方面,2025年《Annals of Hematology》的研究强调,ABO主不合造血干细胞移植会延迟受体血型转换,增加输血需求。这提示血型转换技术的应用需结合患者免疫状态动态评估。对于器官移植领域,建议在血型转换后联合使用免疫抑制剂,以降低抗体介导的排异反应风险。
未来研究方向与技术展望
血型转换技术的核心矛盾在于抗原清除的彻底性与红细胞存活率的平衡。丹麦技术大学的最新研究表明,采用新型糖苷酶组合可将抗原清除率提升至99.9%,同时维持红细胞90%以上的存活率。基因编辑技术如CRISPR-Cas9为永久性血型改造提供可能,通过敲除ABO基因或修饰糖基转移酶活性,可从根本上消除抗原表达。
在安全验证方面,需建立多层次评估体系:第一层通过流式细胞术检测抗原残留量;第二层采用补体依赖性细胞毒性试验(CDC)评估溶血风险;第三层开展灵长类动物模型的长周期观察。东南大学团队正在开发的体外循环模型,可模拟不同血流动力学条件下的溶血效应,为技术优化提供数据支撑。
总结而言,O型血向AO型血的转化在技术上已取得突破,但其临床应用仍受限于抗原残留引发的免疫风险。未来的研究需聚焦于精准控制抗原清除阈值、开发长效转化技术,并建立配套的风险预警系统。在确保安全性的前提下,这项技术有望缓解全球血液供应短缺,为特殊血型患者开辟新的治疗途径。


