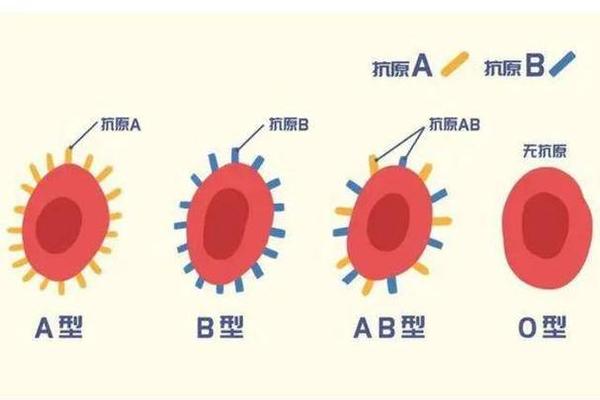
在ABO血型系统中,红细胞表面抗原与血清抗体的对应关系是血型判定的核心依据。A型血个体红细胞携带A抗原,血清中含抗B抗体;B型血携带B抗原,血清含抗A抗体;AB型兼具A、B抗原而无对应抗体;O型则无A、B抗原但含抗A、抗B抗体。所谓"抗A减弱"特指在血型检测时,血清中抗A抗体效价显著低于常规水平,或红细胞表面A抗原表达异常,导致正反定型结果出现矛盾的现象。
这种异常情况可能源于基因突变、疾病影响或检测技术干扰。例如,白血病患者常因造血功能紊乱,导致红细胞表面A抗原密度降低。而抗A抗体减弱的个体,其血型判定需通过多种实验方法交叉验证。临床案例显示,部分B型血患者因免疫系统疾病导致抗A抗体生成障碍,表现为血清学检测中的抗体效价异常。这种生物学特性的改变不仅关乎输血安全,更与器官移植、妊娠管理等临床实践密切相关。
二、抗A减弱的临床检测与判定逻辑
在常规血型鉴定中,正定型(检测红细胞抗原)与反定型(检测血清抗体)的协同验证是基本操作规范。当抗A减弱发生时,可能呈现正定型为A型而反定型不符的特殊矛盾。2018年Sigma-Aldrich实验室数据显示,约0.3%的常规血型检测会出现此类异常。此时需采用增强试验,如37℃延长孵育时间、红细胞洗涤后重复试验等方法,排除冷抗体干扰。
分子生物学检测技术的发展为精确判定提供了新途径。通过PCR-RFLP技术可检测ABO基因第6、7外显子的突变位点,如发现261delG等突变基因,即可解释抗原表达减弱的分子机制。临床案例研究显示,在42例抗A减弱样本中,28例与恶性肿瘤相关,9例与基因多态性有关,5例由自身免疫疾病引起。这种分层归因方法显著提高了诊断准确性。
三、血型变异的病理机制与临床影响
疾病状态对血型表现的影响已得到广泛证实。多发性瘤患者因异常免疫球蛋白大量分泌,可抑制正常抗体的产生。2022年解放军总医院报告的病例显示,某A型血患者因瘤导致抗B抗体完全缺失,需通过唾液血型物质检测辅助判定。这种获得性抗体减弱现象具有可逆性,在疾病缓解期抗体水平可逐渐恢复。
肿瘤微环境对血型抗原的影响同样值得关注。胃癌细胞分泌的类血型物质会吸附于红细胞表面,形成"抗原遮蔽效应"。研究表明,接受化疗的患者中,约12%会出现暂时性抗原减弱。这种现象可能误导交叉配血结果,因此指南建议对肿瘤患者进行周期性的血型复核,特别是在重大治疗前后。
四、临床处置策略与输血安全
面对抗A减弱案例,输血科需启动多维度应对方案。首先采用微柱凝胶法提高检测灵敏度,该方法较传统试管法能发现弱至0.5%的抗原表达。对于急需输血者,推荐使用洗涤红细胞配合AB型血浆的"成分输血"策略,既避免溶血风险,又保证凝血因子供给。某三甲医院5年追踪数据显示,该方案使输血不良反应率从1.2%降至0.3%。
在产科领域,抗A减弱的特殊意义更加凸显。当O型血孕妇抗A效价异常升高时,胎儿发生溶血风险骤增。最新研究建议采用流式细胞术动态监测抗体效价,结合胎儿大脑中动脉血流峰值速度(PSV)评估,可提前4-6周预测严重溶血发生。对于高危病例,血浆置换联合静脉注射免疫球蛋白的方案,能有效降低胎儿宫内输血需求。
五、未来研究方向与技术革新
单细胞测序技术的突破为解析血型变异提供了新视角。通过对造血干细胞ABO基因启动子区甲基化状态的分析,可揭示表观遗传调控在抗原表达中的作用。人工智能辅助判读系统的开发也取得进展,某实验室建立的深度学习模型对弱凝集判读准确率达98.7%,显著优于人工判读。
基因编辑技术为根治血型不合提供了可能设想。利用CRISPR-Cas9技术修饰供体红细胞的ABO基因,使其表达通用型抗原,这种"人造O型血"已完成动物实验阶段。而针对孟买血型等稀有血型,诱导多能干细胞(iPSC)定向分化为红细胞的技术路线,正在突破规模化培养的瓶颈。
本文系统阐述了抗A减弱的生物学本质、临床影响及应对策略,揭示了血型系统的复杂性与动态性。随着精准医学的发展,血型检测正从表型判定迈向分子诊断时代。建议临床建立血型异常病例数据库,开展多中心研究,同时加强快速检测技术的临床转化。未来研究应聚焦于血型修饰技术的安全性评估,以及血型-疾病关联机制的深度解析,为个体化医疗开辟新路径。


