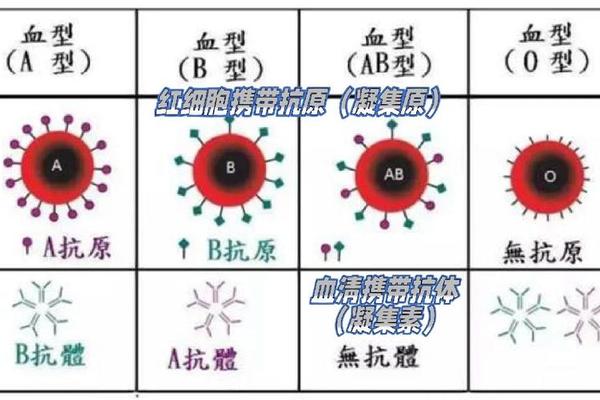
在人类复杂的遗传密码中,血型基因如同一把解开生命奥秘的钥匙。ABO血型系统的核心由IA、IB和i三个等位基因构成,其中IA基因通过编码特定的糖基转移酶催化A抗原的合成,而i基因作为隐性等位基因,无法产生功能性酶,最终形成O型血的表型。AB型血则因其独特的IAIB基因型,表现出共显性特征,成为唯一同时携带A、B抗原的血型。这种基因与表型的复杂对应关系,不仅塑造了个体间的生理差异,更在医学、人类学等领域引发持续探索。
一、血型基因的分子机制与抗原表达
IA基因位于9号染色体长臂(9q34),其编码的α-1,3-N-乙酰半乳糖胺转移酶,能够将N-乙酰半乳糖胺连接到H抗原的糖链末端,形成A抗原。这一过程依赖于H抗原的存在——H抗原本身由FUT1基因编码的岩藻糖转移酶催化生成。若H抗原缺失(如孟买血型),即便携带IA基因也无法表达A抗原,此时表型呈现为类似O型的Oh型,揭示了基因互作中的隐性上位效应。
i基因作为隐性等位基因,其产物缺乏酶活性,无法对H抗原进行修饰,因此ii基因型个体仅保留H抗原的基本结构,表现为O型血。值得注意的是,i基因并非完全无功能,其在不同种群中的变异频率(如东亚人群中O型占比约30%)可能与传染病选择压力有关。例如,部分研究表明O型血对疟疾的抵抗力可能推动了其在热带地区的自然选择。
二、遗传规律与表型传递的复杂性
ABO血型遗传严格遵循孟德尔定律,但基因型与表型的对应存在多重可能。IA和IB为共显性基因,i为隐性基因,因此AB型(IAIB)必然由父母各提供一个显性等位基因。而A型血个体可能是IAIA纯合子或IAi杂合子,这使得A型父母可能生出O型子女(当双方均为IAi时,有25%概率传递i基因)。2017年上海交通大学团队对18000名志愿者的追踪发现,A型血人群消化系统肿瘤风险较其他血型高15%-25%,提示基因型差异可能通过抗原-抗体反应影响疾病易感性。
法医学中,血型遗传规律常作为亲子鉴定的辅助依据。例如,AB型父母不可能生育O型子女,这一原则在99.7%的案例中成立。但孟买血型等特殊情况的出现(发生率约万分之一),要求鉴定时必须结合H抗原检测,否则可能造成误判。日本学者山本在1990年首次解析IA/IB/i基因的DNA结构,发现IA与IB基因仅相差4个关键碱基,这种微小差异却决定了抗原性质的本质区别。
三、临床意义与进化溯源
在输血医学中,AB型因缺乏抗A/B抗体被称为“万能受血者”,但其血浆中的抗H抗体可能引发孟买血型受血者的溶血反应。2021年加拿大研究显示,O型血人群感染新冠病毒的风险较其他血型低12%,重症率低13%,可能与抗A抗体中和病毒刺突蛋白的机制相关。而AB型人群由于缺乏特定的凝血因子抑制物,其静脉血栓风险比O型高40%,这为个性化抗凝治疗提供了依据。
从进化视角看,IA基因可能起源于2.5万年前的农耕社会。考古DNA分析显示,早期欧洲采集者中O型占主导,而农业革命后IA基因频率显著上升,可能与谷物饮食引发的免疫适应有关。IB基因则被认为在1.5万年前出现于喜马拉雅山地区,蒙古人群携带率达34%,其地理分布与游牧文明的扩张轨迹高度吻合。达达莫博士提出的“血型进化假说”指出,AB型作为最晚出现的血型(不足千年),反映了不同人群基因交流的加剧,但其易患恶性肿瘤的特性提示进化代价的存在。
四、前沿探索与未来方向
基因编辑技术为血型研究开辟了新维度。2024年《自然·生物技术》报道,科学家利用CRISPR-Cas9将A型红细胞转化为O型,成功率超97%,这项突破有望缓解全球血源短缺。而针对孟买血型的基因治疗试验已进入临床Ⅰ期,通过腺病毒载体递送功能性FUT1基因,初步实现H抗原的表达。群体遗传学研究还发现,3号染色体上的SLC6A20基因多态性与ABO血型协同影响COVID-19重症风险,揭示多基因互作在疾病中的复杂作用。
未来研究需在三个方向突破:一是建立血型基因变异与慢性病的动态关联模型,二是开发通用型人工血液制品,三是探索血型抗原在器官移植排斥反应中的调控机制。正如诺贝尔奖得主兰德施泰纳在1930年颁奖典礼所言:“血液中的遗传密码,终将揭示人类适应自然的生存策略。” 从输血安全到疾病防控,从人类迁徙到基因治疗,血型基因的研究将持续为生命科学提供关键洞见。