人类血型系统的复杂性不仅体现在ABO与Rh两大核心分类上,更在于基因层面的隐性表达与显性传递。当面对A型或B型血个体时,如何判断其基因型是纯合型(AA/BB)还是杂合型(AO/BO)?这一问题既是医学检验的技术难点,也是遗传学研究的核心命题。而在Rh血型系统中,RhBB等罕见表型的鉴定同样挑战着临床精准医疗的边界。本文将围绕血型基因型判定的科学原理、检测技术及临床意义展开系统性探讨。
遗传学基础与显隐规律
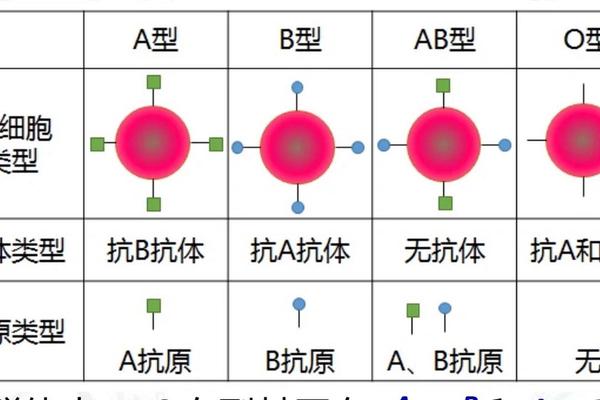
ABO血型系统由第9号染色体上的等位基因控制,A和B为显性基因,O为隐性基因。当个体表现为A型血时,其基因型可能是AA或AO;同理,B型血可能是BB或BO。这种显隐关系源于抗原表达的分子机制:A基因编码N-乙酰半乳糖胺转移酶,B基因编码半乳糖转移酶,而O基因因碱基缺失导致酶活性丧失。AO基因型个体虽携带隐性O基因,仍能通过显性A基因表达完整A抗原。
Rh血型系统则涉及50多个抗原,其中D抗原的临床意义最为突出。Rh阳性(Rh+)表示存在D抗原,阴性(Rh-)则缺失该抗原。RhBB等复杂表型通常与D抗原的弱表达或部分缺失相关,例如D变异型(DVI、Dpartial等),这类情况在常规血清学检测中易被误判为Rh阴性。研究表明,东亚人群中D变异型的发生率可达0.3%,远高于白种人的0.03%。

检测技术的双重路径
传统血清学方法通过抗原抗体反应进行表型判定。对于ABO系统,采用抗A、抗B标准血清与红细胞凝集试验,辅以反向定型验证血清中的天然抗体。但该方法无法区分AA与AO基因型,此时需引入家系分析——若父母中一方为O型,则A型子代必为AO基因型。例如父亲为O型(ii)、母亲为A型(AA/AO),其子女A型血的基因型只能是AO。
分子生物学技术为基因型判定带来突破。PCR-SSP(序列特异性引物扩增)可特异性识别A、B、O等位基因,通过电泳条带判断基因型。针对Rh系统,多重连接探针扩增(MLPA)技术能检测RHD基因的拷贝数变异,准确识别Rh阴性个体的基因型(如RHD全缺失型或杂交基因型)。研究发现,中国汉族Rh阴性人群中,约25%存在RHD-CE杂交基因,这类个体可能产生抗D抗体,需特殊输血管理。
临床决策的深层影响
基因型信息直接关系输血安全。AO型供血者的红细胞虽与AA型表型相同,但其血浆中含抗B抗体,若大量输注给AB型患者可能引发溶血反应。在Rh系统中,D变异型个体若误输Rh阳性血液,可能诱发抗D抗体产生,导致后续妊娠发生新生儿溶血病。日本学者曾报道,某D变异型产妇因未及时进行基因检测,第二胎出现重度高胆红素血症,最终需换血治疗。
在器官移植领域,HLA分型与血型基因型的联合分析成为新趋势。研究发现,ABO基因型相容(如O型供体对任何受体)可降低移植物抗宿主病发生率,而杂合型供体的HLA配型优势更显著。美国梅奥诊所的队列研究显示,采用基因型匹配的肾移植患者,5年存活率较表型匹配组提高12%。
技术瓶颈与未来突破
现有检测体系仍存在局限性:血清学方法对弱抗原敏感性不足,而基因检测成本较高。针对ABO亚型(如A3、B3),流式细胞术通过荧光标记单克隆抗体可实现定量分析,其灵敏度达98.7%,较传统凝集试验提升20%。人工智能算法的引入更开创了新维度——斯坦福大学开发的深度学习模型,通过分析百万份血型数据,可预测罕见基因型的出现概率,准确率达89%。
群体遗传数据库的建设是另一突破方向。全球血型基因组计划(GloBType)已收录120万人群的基因型数据,通过全基因组关联分析发现,ABO基因座与胃癌易感性存在显著相关性(OR=1.18,p=3.2×10^-6)。这类成果不仅完善了血型理论体系,更推动了个体化医疗的发展。
血型基因型的精准判定是连接遗传学理论与临床实践的关键纽带。从血清学表型到分子基因型的技术跨越,不仅解决了输血医学的历史难题,更揭示了血型系统与疾病易感性的深层关联。未来研究需着重于三方面:一是开发低成本快速基因分型技术,二是建立区域性血型基因数据库,三是探索CRISPR等基因编辑技术在稀有血型红细胞体外制备中的应用。唯有融合多学科前沿成果,方能实现从"血型匹配"到"基因适配"的范式变革。


