人类对血型系统的探索始于20世纪初卡尔·兰德施泰纳的突破性发现,这项研究不仅揭示了红细胞表面抗原与血浆抗体的精密平衡,更在临床医学中掀起了一场输血安全的革命。在ABO血型系统中,A型血与AB型血的抗体分布差异构成了免疫防御的独特图景——A型血个体血浆中天然存在的抗B抗体,与AB型血人群免疫系统的"宽容性"形成鲜明对比。这种生物学特性的差异,既影响着输血医学的实践准则,也牵动着母婴健康与疾病易感性的复杂网络。
抗原抗体分布的分子密码
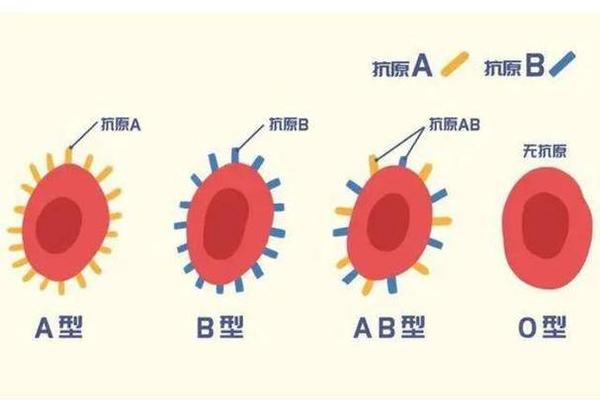
ABO血型系统的核心在于红细胞表面糖基化修饰的精密调控。A型血的红细胞通过α-1,3-N-乙酰半乳糖胺转移酶的作用,在H抗原基础上添加特定糖基形成A抗原,这一过程由9号染色体上的A等位基因编码决定。与之对应的血浆中抗B抗体,实际上是针对B型抗原(半乳糖修饰结构)的天然IgM抗体,其产生机制与生命早期接触的肠道菌群抗原表位交叉反应密切相关。
AB型血作为ABO系统中的特殊存在,其红细胞表面同时呈现A、B两种抗原,这种双重表达源于个体同时携带A和B等位基因。由于机体免疫系统对自身抗原的耐受机制,AB型血个体的血浆中既不存在抗A抗体,也不产生抗B抗体。这种免疫宽容的特性源于胚胎期胸腺的阴性选择过程,任何可能攻击自身抗原的B细胞克隆都会被清除,确保免疫系统仅针对外来抗原产生应答。
临床医学的双刃剑效应
在输血实践中,A型血的抗体特性要求严格的配型规则。当A型血受者输入B型或AB型血液时,血浆中的抗B抗体会迅速引发补体级联反应,导致输入红细胞溶解。这种溶血反应不仅使血红蛋白丧失携氧能力,其释放的毒性物质还可能引发急性肾损伤等并发症。值得注意的是,即便是O型血作为"万能供血者",其血浆中的抗A、抗B抗体在大量输血时仍可能对A型受者产生不良影响。
AB型血的免疫特性赋予其"万能受血者"的特殊地位,但这种优势也伴随着潜在风险。由于缺乏抗A、抗B抗体,AB型个体在器官移植时对供体血型的兼容范围更广。然而这种免疫宽容可能削弱对某些病原体的防御能力,例如诺如病毒表面的血型抗原模拟结构更易感染AB型个体。在母婴血型不合的案例中,AB型母亲由于缺乏抗A/B抗体,其胎儿发生新生儿溶血症的风险显著低于O型母亲。
遗传进化与免疫平衡
从种群遗传学视角观察,ABO血型的分布呈现显著的地域差异。A型血在欧洲人群中的高频率(约40%)与AB型血在亚洲部分地区的较高比例(约10%),暗示着不同病原体选择压力对血型基因频率的影响。分子进化研究表明,A、B等位基因的分化时间早于智人走出非洲的迁徙事件,其多态性的维持可能与霍乱、天花等传染病的周期性流行有关。
免疫系统的这种平衡机制在新型冠状病毒大流行中展现出新的研究维度。2020年中国学者发现A型血人群感染风险较O型血高45%,可能与呼吸道细胞表面ABO抗原影响病毒吸附有关。而AB型血由于同时具有A、B抗原的特殊性,其感染风险呈现独特的中间状态,这为研究血型抗原与病毒受体的相互作用提供了新的模型。值得注意的是,这些发现尚需更大规模的多中心研究验证,特别是需要阐明抗体滴度与疾病严重程度的相关性。
未来研究的生物医学图景
对ABO抗体系统的深入解析正在开启精准医疗的新篇章。在肿瘤免疫治疗领域,基于血型抗原的CAR-T细胞改造策略已进入临床试验阶段,其原理是利用红细胞抗原的特定表达模式实现靶向治疗。在疫苗研发中,血型相关糖链结构的相似性提示我们需要关注疫苗抗原设计与天然抗体的交叉反应风险。建立血型抗体动态监测数据库,将有助于优化稀有血型库的管理策略,特别是在Rh阴性等特殊血型的应急保障方面。
当前研究的前沿正朝着分子机制与临床转化双向突破。单细胞测序技术可揭示不同血型个体B细胞受体库的差异,而冷冻电镜技术已成功解析抗B抗体与B抗原的精确结合位点。这些基础研究的突破,将推动血型特异性抗体制剂、人工红细胞等创新产品的开发,最终实现从血型配型到血型精准治疗的范式转变。
血型系统的复杂性与精妙性,恰如生命进化留下的密码之书。A型血与AB型血的抗体差异不仅体现了免疫系统的自我识别智慧,更暗示着人类与微生物协同进化的深远历史。在临床实践中,这种生物学差异要求我们建立更精细化的风险管理体系;在科学研究中,它则为探索免疫耐受机制提供了独特模型。未来跨学科研究的深度融合,必将揭开血型系统更多隐藏的生命奥秘,为人类健康构筑更坚固的免疫长城。


