血液安全是临床医学的基石,而Rh血型系统作为仅次于ABO的第二大血型系统,其抗原鉴定对输血治疗、器官移植及围产期管理具有决定性作用。在Rh系统的五种主要抗原(D、C、c、E、e)中,D抗原的临床认知度最高,但近年研究表明,C、c、E、e抗原的错配同样会引发严重输血反应。以CCDEe表型为代表的Rh复合抗原组合,因其复杂的遗传机制和区域性分布特征,成为精准输血与个体化医疗的关键研究对象。这一领域的研究不仅涉及血清学技术的革新,更推动着分子诊断技术的发展。
抗原系统的生物学基础
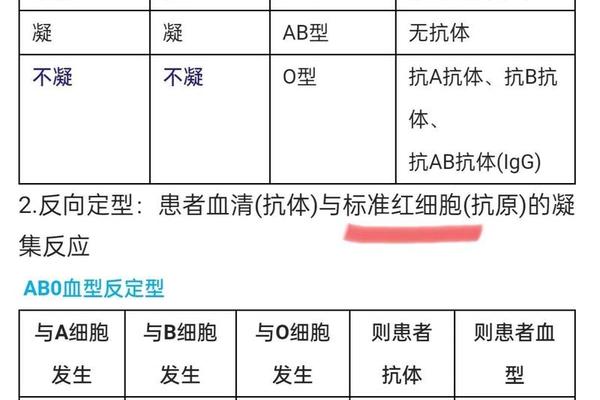
Rh血型系统由RHD和RHCE两个紧密连锁的基因编码,RHD基因决定D抗原表达,RHCE基因则调控C、c、E、e抗原的产生。这些抗原以跨膜蛋白形式锚定于红细胞表面,其抗原表位由蛋白质的三维构象决定。例如,E抗原的形成依赖于RHCE基因第5外显子的特定碱基突变,这种突变导致红细胞膜上呈现独特的抗原决定簇。
在抗原表达强度上,D抗原的免疫原性最强,但E抗原的临床重要性常被低估。研究显示,约60%的Rh系统不规则抗体为抗-E,其发生率甚至高于抗-D。这种现象与E抗原在人群中的分布特征密切相关——白种人中E抗原阳性率约为30%,而亚洲人群则不足15%,抗原频率差异导致跨种族输血时更易产生抗体。
CCDEe表型的遗传密码
CCDEe表型代表红细胞同时携带C、D、E抗原,而c、e抗原缺失的特殊状态,其遗传本质是RHD基因与RHCE基因发生不等交换形成的复合单倍型。分子生物学研究表明,这种单倍型多源于基因重排事件,例如RHCE基因的C区段被RHD基因序列替代,形成C抗原与D抗原的共表达。
中国西南少数民族的血型调查揭示了CCDEe表型的独特分布规律。在德昂族群体中,CDe单倍型频率高达82.5%,显著高于汉族人群的67.3%,这种差异可能与族群迁徙过程中的遗传漂变有关。值得注意的是,该群体中完全缺失cDe单倍型,提示特定环境压力可能筛选出优势单倍型。此类群体遗传学研究为建立区域性血液储备策略提供了科学依据。
鉴定技术的革新突破
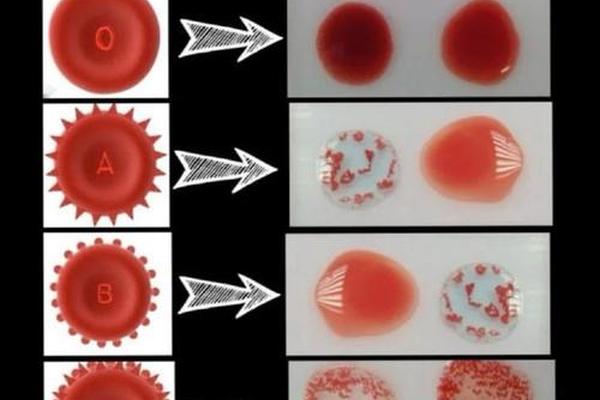
传统血清学方法依赖IgM型单克隆抗体进行抗原检测,但面对弱表达抗原或基因重组产生的变异抗原时,常出现假阴性结果。柱凝集技术的应用显著提升了检测灵敏度,其核心原理是利用葡聚糖凝胶的分子筛效应,将抗原抗体复合物与游离红细胞物理分离。自动化平台的引入使检测通量提升至每小时200样本,同时将人为误差率控制在0.01%以下。
分子诊断技术正在改写血型鉴定的范式。基于PCR-SSP(序列特异性引物扩增)的方法可精准识别RHCE基因的SNP位点,例如针对E抗原的676G>C突变检测。二代测序技术则能完整解析RHD/RHCE基因的复杂重组模式,对CCDEe这类复合表型的鉴定准确率达99.99%。深圳爱康生物研发的全自动血型分析平台,已实现血清学与分子检测的集成化操作。
临床转化的现实挑战
在输血医学实践中,CCDEe表型患者的血液配型面临双重困境:既要避免E抗原引发的回忆反应,又需解决C抗原的错配风险。广东省医院协会制定的《Rh血型抗原检测应用标准》提出分级管理策略:对地中海贫血等长期输血患者,强制要求C、c、E、e抗原全配型;急诊输血则允许D抗原相容前提下的有限错配。这种差异化管理显著降低了迟发性溶血反应的发生率。
围产期监测中,母胎E抗原不合引发的HDFN(胎儿新生儿溶血病)病例逐年增加。上海交通大学附属新华医院的回顾性研究显示,抗-E导致的严重新生儿溶血病占Rh系统病例的28%,远超传统认知。这提示产科血型筛查应从单纯的D抗原检测扩展到全抗原谱分析,特别是对E抗原阴性孕妇加强孕期抗体监测。
未来发展的多维视角
基础研究层面,Rh抗原的三维结构解析为人工抗原表位设计开辟新路径。冷冻电镜技术已揭示E抗原与抗体结合的精确空间构象,这为开发重组抗原检测试剂奠定基础。临床转化方面,区域性血型数据库建设亟待加强,特别是少数民族和特殊人群的抗原频率数据收集,这将优化血液资源的动态调配。
技术创新领域,微流控芯片技术可实现单红细胞水平的抗原分析,其检测灵敏度达到传统方法的1000倍。合成生物学技术则尝试在工程化红细胞表面定向表达特定抗原组合,这种"定制化"红细胞有望彻底解决稀有血型患者的供血难题。随着精准医学时代的到来,Rh血型鉴定正从被动适配转向主动设计,持续推动输血医学向更高安全层级跃进。


