ABO血型系统是人类最早发现且最重要的红细胞抗原分类体系,其核心在于红细胞表面A、B抗原的有无以及血清中对应抗体的分布。根据红细胞膜上的抗原类型,ABO血型被划分为A型(含A抗原)、B型(含B抗原)、AB型(含A和B抗原)及O型(仅含H抗原)四类,而血清中则存在与抗原互补的抗体:A型血清含抗B抗体,B型含抗A抗体,AB型无抗体,O型则同时携带抗A和抗B抗体。
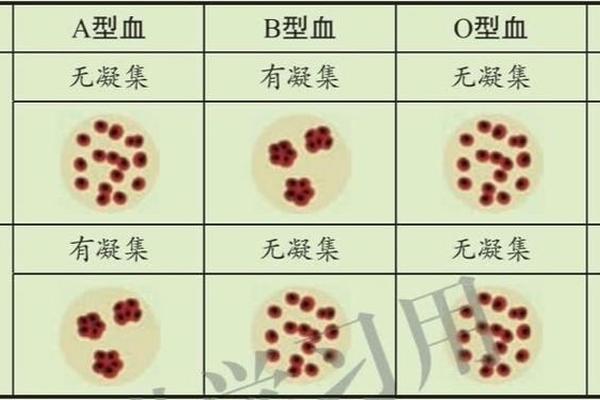
这一系统的发现可追溯至1900年,奥地利科学家Karl Landsteiner通过凝集实验首次揭示了血液的个体差异,并由此奠定现代输血医学的基础。ABO抗原的分子机制由糖基转移酶决定:A型个体携带的α-1,3-N-乙酰半乳糖胺转移酶催化H抗原转化为A抗原,B型则通过α-1,3-半乳糖转移酶生成B抗原,而O型因基因突变导致酶活性缺失,仅保留H抗原。抗原与抗体的特异性反应不仅决定输血相容性,更在器官移植、法医学鉴定和疾病易感性研究中具有深远影响。
血型鉴定的技术演进
传统血型检测主要依赖血清学方法。玻片法作为经典技术,通过肉眼观察抗A/抗B标准血清与红细胞的凝集反应实现定型,操作简便但灵敏度较低,易受抗体效价和亚型干扰。试管法则通过离心加速抗原-抗体结合,显著提升检测速度与准确性,尤其适用于急诊场景。随着技术进步,微柱凝胶法成为主流,其利用凝胶介质分离未结合细胞,通过离心后红细胞滞留位置判断结果,兼具标准化与自动化优势,可将误差率控制在0.1%以下。
新兴技术如流式细胞术正在突破传统局限。通过荧光标记抗体与红细胞的结合分析,该方法能在5分钟内完成亚型鉴定,甚至实现孕妇外周血中胎儿红细胞的非侵入性检测。分子生物学技术的引入则使基因分型成为可能,通过PCR扩增ABO基因外显子区域,可精准识别A2、CisAB等罕见亚型,为疑难血型鉴定提供分子层面的解决方案。
临床应用的多元价值
输血安全是ABO血型系统的首要应用场景。据统计,ABO错型输血引发的急性溶血反应死亡率高达30%-40%,而严格的正反定型联合交叉配血可将风险降至0.004%。在器官移植领域,ABO相容性直接影响移植物存活率,2019-2020年中国儿童活体肝移植数据显示,ABO不相容组术后1年生存率达89.5%,与相容组无统计学差异,这得益于血浆置换和免疫抑制方案的优化。
血型与疾病的关联性研究近年取得突破。Meta分析表明,O型人群胃酸分泌旺盛,消化性溃疡发病率较A型高1.3倍,而AB型个体罹患认知障碍的风险增加1.4倍,可能与TNF-α水平调控和灰质体积差异相关。在结直肠癌中,远端结肠癌细胞异常表达A/B抗原的现象提示血型抗原可能参与肿瘤侵袭过程,其机制涉及α-1,2岩藻糖基转移酶的异常激活。
遗传学特性与亚型挑战
ABO血型的遗传遵循孟德尔定律,由9号染色体上的复等位基因控制。父母分别为A型和B型时,子女可能出现AB型的显性表达或O型的隐性组合,这种遗传稳定性使其在法医学亲子鉴定中具有重要价值。但孟买血型等特殊案例的存在警示着遗传复杂性——该类个体因FUT1基因突变无法合成H抗原,导致常规检测呈现O型假象,需通过唾液血型物质检测确诊。

亚型检测是临床实践的难点。A2B3等弱表达抗原易导致正反定型不符,研究显示采用单克隆抗体与增强剂联用可将检测灵敏度提升10倍。而获得性B抗原现象多见于肠道感染后,因细菌脱乙酰酶作用使A抗原表位改变,此类暂时性血型变异需动态监测以规避误诊风险。
未来发展与精准医学
随着组学技术的进步,血型研究正迈向多维度整合。蛋白质组学分析发现,ABO抗原可修饰vWF因子结构,这为解释非O型人群心血管疾病高发提供了分子机制。合成生物学领域,科学家已成功在酵母中表达功能性A抗原,这为人工血源开发开辟新路径。在精准医疗框架下,基于血型的个体化用药方案正在探索中,例如AB型患者术后抗凝剂用量可能需要调整至O型患者的1.2倍。
建议未来研究聚焦三个方向:一是建立中国人群ABO亚型数据库,目前已知的42种亚型中仅60%完成基因测序;二是开发便携式血型检测设备,纳米传感器技术已实现5μL样本的快速分析;三是深化血型与微生物组互作研究,初步证据显示AB型人群肠道菌群中拟杆菌门丰度较O型高17%,这可能影响营养代谢与免疫应答。
ABO血型系统作为生命科学的里程碑发现,其价值已超越输血医学范畴,在疾病预警、个体化治疗乃至人类进化研究中持续释放潜能。从Landsteiner的原始实验到今日的分子诊断,这项跨越世纪的探索印证着:读懂血液的语言,就是解读生命密码的重要篇章。


