ABO溶血的发生机制源于母体免疫系统对胎儿红细胞的攻击。当母婴血型不合时,胎儿红细胞表面的A或B抗原可能刺激母体产生免疫球蛋白G(IgG)抗体,这些抗体通过胎盘进入胎儿血液循环,与红细胞结合后引发溶血反应。ABO血型系统由A、B、O三种等位基因决定,其中AB型个体的红细胞同时携带A和B抗原,血清中不含抗A或抗B抗体。若母亲为AB型血,其体内缺乏针对A或B抗原的抗体,理论上不会因ABO血型不合导致胎儿溶血。
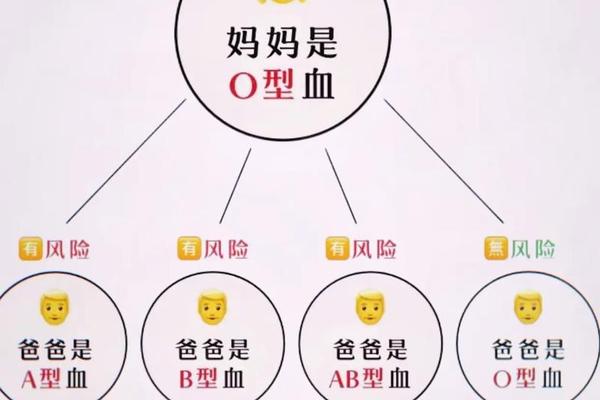
血型遗传的复杂性在于父母双方的基因组合。当母亲为AB型时,其子代血型可能为A、B或AB型,但无论父亲是何种血型,母体均无法产生针对这些血型的IgG抗体。这一特性使得AB型母亲成为ABO溶血风险极低的群体。相反,若母亲为O型血且胎儿为A或B型,则因母体天然存在抗A/B抗体,可能引发溶血。在AB型母亲的妊娠中,父亲的血型并不构成ABO溶血的直接风险因素。
Rh血型系统的重要性与风险
尽管ABO溶血的概率在AB型母亲中可忽略不计,Rh血型不合仍需警惕。Rh阴性(俗称“熊猫血”)母亲若怀有Rh阳性胎儿,可能因胎儿红细胞进入母体引发免疫反应,导致后续妊娠中胎儿发生严重溶血。这一机制与ABO溶血的差异在于,Rh抗体需通过初次暴露(如分娩或流产)致敏产生,因此第一胎通常不受影响,但随着妊娠次数增加,风险显著上升。
对于AB型母亲而言,若同时为Rh阴性,则需特别关注父亲Rh血型。若父亲为Rh阳性,胎儿有50%概率遗传Rh阳性基因。此时需通过产前抗体效价检测及产后新生儿溶血筛查进行监测,必要时使用抗D免疫球蛋白预防致敏。例如,2018年《新生儿高胆红素血症诊断和治疗专家共识》指出,Rh阴性孕妇在妊娠28周及分娩后72小时内注射抗D免疫球蛋白,可有效降低致敏概率至1%以下。
临床诊断与干预策略

产前血型抗体检测是预防新生儿溶血的关键。对于AB型孕妇,常规ABO血型抗体筛查通常显示阴性,但若合并其他罕见血型系统(如Kell、Duffy)不合,仍需通过不规则抗体筛查评估风险。例如,2024年乐山市中心血站的研究表明,约0.3%的溶血病例由非ABO/Rh血型系统引起,这类病例的诊断需依赖特异性抗体鉴定技术。
在治疗层面,ABO溶血多采用光疗和药物治疗。2023年《静丙治疗新生儿溶血各国指南对比》显示,静脉注射免疫球蛋白(IVIG)可通过阻断抗体与红细胞结合,使85%的中度溶血患儿免于换血治疗。而Rh溶血由于病情进展快,常需提前准备Rh阴性血源以备换血之需。值得注意的是,我国2011年曾出现针对ABO血型不合的过度医疗现象,部分医疗机构通过中药干预“预防”实际上无需治疗的生理性黄疸,这种做法已被证实缺乏科学依据。
遗传咨询与社会认知误区
公众对血型遗传存在两大认知偏差:一是夸大ABO血型不合的风险,二是忽视Rh血型的重要性。统计显示,我国O型血孕妇中仅0.6%的新生儿出现需治疗的ABO溶血,且其中90%可通过光疗治愈。而Rh阴性孕妇若不进行规范管理,二胎发生溶血的风险可达16%,且重症病例死亡率高达10%。
基因检测技术的进步为精准预防提供了新方向。例如,无创产前检测(NIPT)可通过母体血液中的胎儿DNA片段判断Rh基因型,准确率达99%以上。干细胞移植技术已在实验阶段实现Rh阴性胎儿的宫内治疗,未来或可从根本上解决Rh溶血问题。
AB型母亲因自身血型特性,无需担忧ABO溶血风险,但需重视Rh血型及其他稀有血型系统的筛查。父亲血型的影响主要体现在Rh基因的遗传概率上,而非ABO系统。当前医疗实践已形成完整的“筛查-预防-治疗”体系,通过抗体效价监测、免疫球蛋白注射及换血疗法,可将溶血相关死亡率控制在0.1‰以下。
未来研究应聚焦于三方面:一是开发更灵敏的早期预警生物标志物,二是优化罕见血型不合的干预方案,三是加强公众科普以消除非理性焦虑。正如2025年《ABO溶血症概率揭秘》研究所言:“科学的认知与规范的诊疗,是化解血型遗传焦虑的最佳良药”。


