人类对血型系统的探索始于20世纪初,而ABO血型作为最早被发现且临床意义最为重大的分类体系,至今仍在输血医学、器官移植和遗传学研究中占据核心地位。在A型血的范畴内,科学家发现了更为精细的亚型分化现象——例如A1、A2乃至罕见的A3等亚型,这些差异源于基因层面的微妙变化,直接影响着红细胞表面抗原的表达强度。这种分子层面的多样性,既为生命科学提供了研究模板,也在临床实践中带来挑战。理解A型亚型的形成机制,不仅关乎血液安全的精准把控,更是解开人类遗传密码的重要线索。
遗传编码的分子密码
A型亚型的本质差异植根于9号染色体上的ABO基因序列。该基因通过编码α-1,3-N-乙酰半乳糖胺转移酶,催化H抗原转化为A抗原。正常A型个体的IA等位基因含有7个外显子,其中第6、7外显子负责编码决定酶活性的关键结构域。当基因发生点突变、缺失或插入时,酶蛋白的空间构象将发生改变,导致抗原表位的糖基化修饰不完全。例如在A2亚型中,外显子7的1059-1061位点发生CGG碱基缺失,使得转移酶缺失一个精氨酸残基,最终形成抗原决定簇数量减少的弱表达型。
这种遗传变异具有显性遗传特性。2017年江苏发现的A3亚型案例中,研究者通过基因测序发现患者ABO基因第7外显子存在c.721C>T突变,导致脯氨酸被丝氨酸取代,削弱了转移酶与底物的结合能力。类似的突变模式在Ael、Ax等稀有亚型中也有报道,说明不同位点的碱基变异会通过改变酶活性中心或底物识别区域,产生梯度化的抗原表达强度。
血清学表型的多维度验证
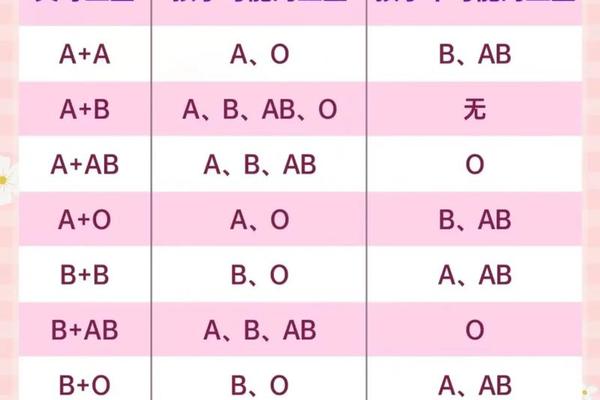
在临床检测中,A亚型的鉴定需要血清学与分子生物学的双重验证。经典的血凝试验显示,A1亚型红细胞与抗-A1凝集素能产生强凝集反应,而A2亚型仅呈现弱凝集甚至不凝集。更精密的流式细胞术可量化抗原密度差异:A1型红细胞表面抗原数可达81-120万/细胞,A2型则降至24-29万/细胞。这种数量级差异直接影响了输血相容性——当A2型供血者的红细胞输入含强效抗-A1抗体的O型受血者体内时,可能引发溶血反应。
针对特殊案例的深入分析往往需要基因分型技术辅助。例如在广东某亲子鉴定纠纷中,父亲看似O型的血清学结果实为B亚型,通过PCR-SSP法检测发现其携带的B等位基因存在外显子6的796C>A突变,导致合成的半乳糖转移酶活性降低。这种血清学与基因检测的互补策略,已被写入《输血医学技术操作规程》,成为解决血型疑难问题的标准流程。
临床实践中的双重挑战
A亚型的精准识别直接关乎输血安全。统计显示,约1-8%的A型人群属于A2亚型,其血浆中可能天然存在抗-A1抗体。若将A1型血液误输给此类患者,抗体与供体红细胞的强烈反应可能诱发急性溶血。在江苏A3亚型案例中,研究者特别强调:该孕妇若需输血,必须选择A3型或O型洗涤红细胞,常规A型血中的抗-A抗体可能攻击其弱表达抗原。这种特殊性使得稀有血型库的建立成为区域性医疗中心的重要任务。
在母婴医学领域,A亚型的遗传规律更显复杂。当母亲为O型而胎儿遗传父亲A亚型时,母体产生的IgG型抗-A抗体可穿过胎盘屏障。但不同于典型ABO溶血,弱A抗原引发的抗体效价往往较低,导致临床监测中易出现漏诊。日本学者山本的研究指出,携带Ax亚型的胎儿发生高胆红素血症的概率是正常A型的3.2倍,提示产科需建立更灵敏的抗体筛查体系。
技术革新下的认知突破
二代测序技术的应用正在改写A亚型的研究范式。通过对ABO基因全长20kb区域的高通量测序,研究者已发现超过380种等位基因变异。这些数据不仅完善了血型数据库,更揭示出突变热点区域:例如外显子7的核苷酸突变占所有A亚型变异的67%,提示该区域在酶功能维持中的核心地位。基于此开发的微阵列芯片检测技术,可在6小时内完成127种已知突变的同步筛查,将亚型鉴定效率提升40倍。
合成生物学的发展为人工改造血型抗原开辟了新路径。2023年《自然·生物技术》报道的基因编辑方案,可在体外将O型红细胞精确修饰为特定A亚型,这种技术突破对解决稀有血型供应难题具有战略意义。但学家也警告,此类技术可能引发"定制血型"的商业化滥用,亟需建立全球监管框架。
从卡尔·兰德施泰纳发现ABO血型至今,人类对A亚型的认知已从血清学现象深入到分子机制层面。当前研究证实,A亚型的多样性既是自然选择的遗传印记,也是基因突变累积的微观呈现。在临床层面,建立基于基因分型的精准输血体系、完善稀有血型应急保障机制,已成为提升医疗质量的关键举措。未来研究应聚焦于:开发更经济的快速检测试剂盒、探索CRISPR技术在血型转换中的应用边界、以及构建覆盖多族群的A亚型遗传图谱。唯有持续深化对血型微观世界的探索,才能筑牢生命安全的基石。



