血液作为生命流动的载体,其类型划分不仅关乎医疗救治的精准性,更与人类健康风险紧密相连。在ABO血型系统中,A型血因其独特的抗原-抗体特性,成为医学界持续关注的对象。一方面,A型血在输血适配性上存在明确限制;流行病学研究揭示其与特定疾病的高度关联性,使其被冠以“危险血型”的争议标签。这种双重属性促使我们深入探索A型血的生物学本质及其社会意义。
一、ABO血型系统的输血适配性
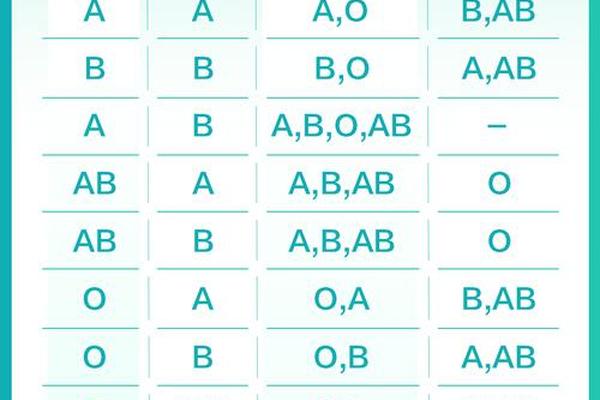
在ABO血型系统中,A型血的红细胞表面携带A抗原,血浆中含有抗B抗体。这一特性决定了其输血兼容范围的局限性。根据国际输血协会指南,A型血患者可接受A型或O型供血者的红细胞,但需严格排除B型及AB型血液,否则抗B抗体会引发致命性溶血反应。例如在紧急输血时,O型血因缺乏A/B抗原成为“万能供体”,但其血浆中的抗A抗体仍需通过成分分离处理才能安全输入A型患者体内。
输血适配性的复杂性还体现在Rh血型系统的叠加影响。若A型血患者为Rh阴性(俗称“熊猫血”),其输血选择将更加受限——必须使用Rh阴性的A型或O型血液。我国汉族人群中Rh阴性比例不足1%,这种稀有性使得A型Rh阴性患者的临床用血保障面临严峻挑战。值得注意的是,2022年剑桥大学通过酶处理技术成功将A型肾脏转化为O型的研究,为突破血型限制提供了新思路。
二、疾病易感性的生物学关联
多项大规模队列研究揭示了A型血与特定疾病的显著相关性。2023年《自然》子刊发表的60万人群研究显示,A型血人群早发性中风风险较其他血型增加18%,其机制可能与血液中von Willebrand因子浓度偏高导致的凝血倾向有关。这种促凝特性在新冠感染中同样显现——2020年《新英格兰医学杂志》数据显示,A型血患者重症率较O型血提升45%,可能与病毒刺突蛋白与A抗原的结构相似性有关。
在肿瘤领域,A型血的易感性呈现器官特异性。中国抗癌协会2023年报告指出,A型血人群胃癌发病率较其他血型高26%,可能与胃黏膜细胞表面A抗原更易被幽门螺杆菌定植有关。这种生物学脆弱性在消化系统尤为突出,韩国首尔大学研究发现,A型血人群肠道菌群中促炎菌株的比例显著高于其他血型。
三、遗传与免疫机制的深层解读
A型血的遗传密码位于9号染色体长臂的ABO基因位点。基因测序显示,A等位基因携带者表达α-1,3-N-乙酰半乳糖胺转移酶,该酶催化H抗原转化为A抗原。这种酶活性不仅决定红细胞表型,还影响血浆中糖蛋白的糖基化修饰。2024年哈佛医学院研究发现,A型个体唾液酸转移酶活性异常,可能导致免疫细胞表面信号分子异常暴露,从而诱发自身免疫反应。
在免疫应答层面,A型血呈现独特的炎症反应模式。德国马克斯·普朗克研究所实验显示,A型血单核细胞在TLR4受体激活后,IL-6、TNF-α等促炎因子分泌量较O型血增加40%。这种过度炎症反应可能解释为何A型血患者在心脑血管事件中组织损伤更严重。表观遗传学研究还发现,A型血人群DNA甲基化模式在凝血因子Ⅷ基因启动子区域存在特异性修饰。
四、社会认知与科学应对策略
面对A型血的特殊风险属性,建立科学防控体系至关重要。临床建议A型血人群每半年监测纤维蛋白原、D-二聚体等凝血指标,45岁以上者推荐每年进行颈动脉超声筛查。生活方式干预方面,日本厚生劳动省2024年指南强调,A型血个体应增加ω-3脂肪酸摄入,将饱和脂肪比例控制在总热量7%以下,以此调节促凝状态。
在公共卫生层面,血型风险评估需要避免绝对化。虽然统计学显示A型血具有特定疾病倾向,但个体差异受多基因调控。美国国立卫生研究院2025年启动的“精准血型医学”项目,正通过百万级人群的多组学数据分析,构建个性化风险预测模型。我国东南大学研发的A型转O型酶技术已进入Ⅲ期临床试验,未来或可从根本上消除血型相关的输血风险。
血型作为遗传赋予的生命密码,既非命运枷锁,也非健康护符。A型血的特殊生物学属性,既要求我们正视其医学风险,更需要以发展的眼光看待技术进步带来的解决方案。在精准医学时代,通过基因编辑、人工酶转化等前沿技术,人类正逐步突破血型限制。未来研究应聚焦于血型与疾病关联的分子机制解析,以及跨血型器官移植技术的临床转化,让每个生命都能平等享受医学进步的福祉。


