在医学常识中,血型常被认为是与生俱来且终身不变的遗传特征。近年来临床案例和研究显示,某些特殊情况下,个体的血型可能发生“A型转为B型”等表观变化,甚至基因层面的永久性改变。这一现象不仅挑战了传统认知,也为输血医学、器官移植等领域带来新的启示。本文将从科学角度解析血型转变的机制,并探讨其背后的医学意义。
一、基因层面的稳定性与异变
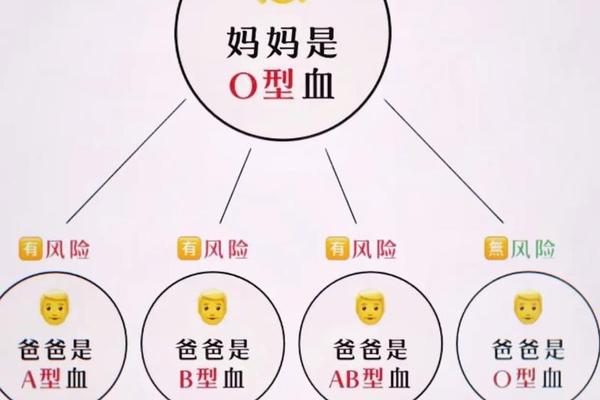
ABO血型系统由第9号染色体上的等位基因决定,A型对应A抗原,B型对应B抗原,O型则无这两种抗原。正常情况下,基因序列的稳定性决定了血型的终身不变性。但造血干细胞移植可颠覆这一规律:当A型患者接受B型供体的移植后,供体的造血干细胞逐渐取代患者自身的造血系统,导致红细胞抗原完全转变为B型,这种基因层面的改变具有永久性。
值得注意的是,某些疾病可能造成基因表达的暂时性干扰。例如白血病患者的癌细胞可能抑制正常红细胞的生成,导致A抗原表达减弱,在血型检测中呈现“类B型”特征。但这种表观变化并非基因突变,随着病情缓解可能恢复原有血型。
二、疾病与治疗的干扰效应
恶性肿瘤对血型抗原的影响尤为显著。研究显示,约15%的消化系统肿瘤患者会出现抗原遮蔽现象:肿瘤分泌的唾液黏蛋白覆盖红细胞表面的A抗原,导致血清学检测误判为B型或AB型。这类“伪转变”可通过抗原修复实验鉴别,本质是抗原可及性降低而非真实改变。
化疗药物则可能通过双重机制干扰血型:一方面破坏红细胞膜上的糖基转移酶,抑制抗原合成;另一方面直接损伤DNA修复机制,诱发罕见的基因突变。日本学者曾报道一例淋巴瘤患者,在长期放疗后检测到A到B型的永久性转变,基因测序证实ABO基因发生点突变。
三、微生物的抗原修饰作用
肠道菌群与血型抗原存在微妙互动。2020年丹麦学者在《自然·微生物学》发表突破性发现:嗜黏蛋白阿克曼菌分泌的酶组合可特异性剪切A抗原末端的N-乙酰半乳糖胺,使其暴露出与B抗原相似的结构,导致血清学检测呈现B型特征。这种酶促反应在体外实验中可实现A型红细胞向O型的转化,但误操作可能产生“类B型”中间产物。
临床案例证实,严重肠道感染患者可能出现暂时性血型改变。例如产气荚膜梭菌产生的神经氨酸酶可分解红细胞膜糖蛋白,使A抗原的糖链结构发生重排,在免疫检测中与抗B血清发生交叉反应。这种改变通常在感染控制后2-3周内逆转。
四、医疗技术的突破方向
剑桥大学团队在2022年开展的器官血型改造实验具有里程碑意义。通过灌注携带特定酶的溶液,成功将B型肾脏血管内皮细胞的抗原转换为O型,该技术理论上也可用于定向修饰A型抗原。中国军事医学科学院早在本世纪初即发现咖啡豆来源的α-半乳糖苷酶能剪切B抗原,而改良的工程化酶制剂现可精准识别A抗原的糖基化位点。
基因编辑技术为血型改造提供新思路。CRISPR-Cas9系统已在小鼠模型中实现ABO基因的定向敲除,将A型造血干细胞转化为O型。虽然现阶段技术尚未应用于人体,但为未来个性化输血治疗开辟可能。
血型从A到B的转变本质包含两类机制:表观层面的抗原遮蔽或修饰,以及基因层面的永久性改变。前者常见于疾病状态或微生物干预,后者主要发生在干细胞移植后。当前研究热点集中于酶工程改造和基因编辑技术,旨在开发安全可控的血型转换方案。
未来研究需着重解决三大挑战:提高酶制剂的抗原识别特异性,避免误伤其他膜蛋白;完善体外血型改造的质量控制体系;探索基因编辑的边界。随着合成生物学的发展,或许某天我们能像调节血压一样自如地调控血型,这将彻底改写输血医学的现有格局。


