在医学和生物学领域,血型的分类系统不仅是人类个体差异的重要标识,更深刻影响着临床输血、器官移植乃至疾病预防的实践。当我们看到“A+”或“A-”这样的血型标记时,字母后的“+”与“-”符号代表着Rh血型系统中的关键差异。这种看似简单的符号差异,背后蕴藏着复杂的生物学机制和临床意义。本文将从血型系统的分类逻辑、Rh因子的核心作用、临床实践中的关键问题以及相关研究进展等方面,系统解析A+与A-血型的本质区别。
一、血型分类的生物学基础
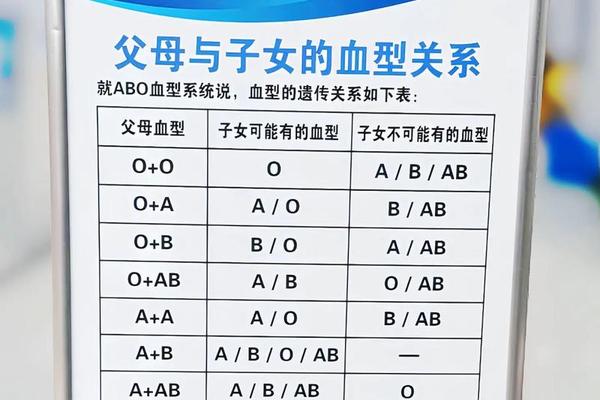
ABO血型系统的分类源于红细胞表面抗原的差异。A型血的红细胞携带A抗原,血清中含有抗B抗体;而B型血则相反,携带B抗原和抗A抗体。这种抗原-抗体的对应关系,由位于第9号染色体上的ABO基因控制。当我们将目光聚焦于A型血时,其内部还存在着更精细的划分——A+与A-的区别源自另一个独立的血型系统:Rh系统。
Rh血型系统的发现可追溯到1940年,科学家在研究恒河猴(Rhesus macaque)血液时首次确认了该系统的存在。Rh系统的核心是红细胞表面D抗原的表达状态,存在D抗原为Rh阳性(+),缺失则为Rh阴性(-)。“A+”代表ABO系统的A型叠加Rh阳性,而“A-”则是A型叠加Rh阴性。这种双重分类体系体现了人类血型系统的多层次特性,既有ABO系统的抗原差异,又有Rh系统的独立补充。
二、Rh系统的核心差异
D抗原的分子本质是跨膜糖蛋白,其编码基因位于第1号染色体。Rh阳性个体的红细胞表面平均分布着约10,000-30,000个D抗原分子,而Rh阴性者由于基因突变导致D抗原完全缺失。这种差异在临床实践中具有决定性意义:当Rh阴性者首次接触Rh阳性血液时,免疫系统会将D抗原识别为异物并产生抗D抗体。这种致敏过程可能引发严重的输血反应或新生儿溶血病。
从人群分布来看,Rh阴性血型在不同种族中呈现显著差异。汉族人群中Rh阴性仅占0.34%,因此被称为“熊猫血”,而欧洲白种人的Rh阴性比例可达15%。这种差异源于遗传选择压力,有研究推测Rh阴性基因可能在某些传染病流行区域具有选择优势。值得注意的是,Rh系统包含超过50种抗原,但临床常规检测仅关注D抗原状态,这是因其免疫原性最强且引发严重反应的风险最高。
三、临床实践中的关键问题
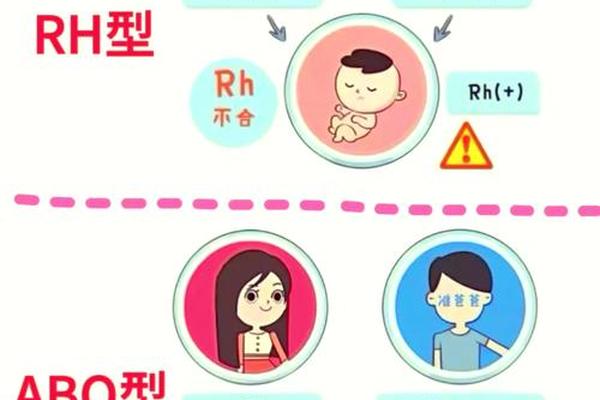
在输血医学领域,Rh系统的匹配原则与ABO系统存在本质差异。ABO血型要求供受体严格匹配,而Rh系统允许Rh阴性者接受Rh阳性血液(仅限于紧急情况),但绝对禁止反向输血。这种不对称性源于抗体产生的动力学特征:Rh抗体属于IgG型,能通过胎盘屏障,且具有记忆性免疫反应的特点。例如,Rh阴性孕妇怀有Rh阳性胎儿时,胎儿的红细胞可能通过胎盘渗入母体,刺激母体产生抗D抗体,导致后续妊娠时发生新生儿溶血。
现代医学已发展出抗D免疫球蛋白干预方案。通过孕期28周和分娩后72小时内注射抗D球蛋白,可有效清除母体循环中的胎儿红细胞,阻断致敏过程。这种预防措施使Rh阴性孕妇的新生儿溶血发生率从17%降至0.1%以下。但对于已产生抗体的个体,仍需要精准的血型匹配和血液成分分离技术,例如采用洗涤红细胞去除血浆中的抗体。
四、遗传机制与研究前沿
Rh血型的遗传遵循孟德尔隐性遗传规律。若父母双方均为Rh阴性(dd),子女必然为Rh阴性;若一方为阳性(DD或Dd),则子女可能携带显性D基因。基因测序技术的进步揭示了Rh阴性形成的分子机制,包括基因缺失、点突变等多种变异形式。例如,2022年江苏发现的全球首例A3亚型突变案例,揭示了ABO基因外显子区域的碱基缺失如何导致抗原表达异常。
当前研究热点聚焦于稀有血型库的建立和人工血液开发。通过诱导多能干细胞(iPSC)技术,科学家已能在体外培养功能性红细胞,这为彻底解决稀有血型供血难题提供了可能方向。基因编辑技术如CRISPR-Cas9的应用,正在探索通过修饰H抗原合成通路来创造通用型红细胞。
A+与A-血型的区别,本质上是人类血液复杂性的微观体现。从D抗原的分子结构到跨代遗传的生物学规律,从输血安全的技术规范到基因治疗的前沿探索,这个简单的“±”符号承载着生命科学百年来的认知突破。未来,随着精准医学的发展,血型系统研究将不仅限于免疫匹配,更可能成为个体化医疗的重要切入点。建议加强公众血型认知教育,完善稀有血型登记制度,并推动合成生物学在血液替代品研发中的应用,这将是保障医疗安全、促进生命科学进步的关键举措。


