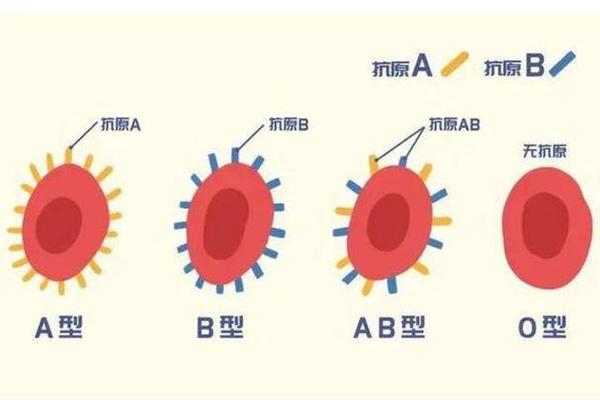
A型血的红细胞表面携带的A抗原,本质上是一种由糖脂和糖蛋白构成的复合糖链结构。其核心分子基础是H抗原前体在特定酶催化作用下形成的特异性糖基修饰。根据瓦特金斯等学者的研究,A抗原的末端糖基为N-乙酰半乳糖胺(GalNAc),这一特征性结构使其能够被抗A抗体特异性识别。这种糖链的合成过程由基因编码的糖基转移酶精确调控——A基因(IA)编码的α-1,3-N-乙酰半乳糖胺转移酶,能够将GalNAc连接到H抗原的β-D-半乳糖末端,从而完成A抗原的生物合成。
从遗传学角度分析,A抗原的形成依赖于ABO基因座的显性表达。当个体携带至少一个IA等位基因时,红细胞即可表达A抗原。值得注意的是,H抗原的完整表达是A抗原形成的前提条件。在罕见的孟买血型(hh基因型)个体中,由于缺乏H抗原前体,即使携带IA基因也无法生成功能性A抗原。这种分子层面的级联反应机制,揭示了血型系统在遗传表达中的复杂调控网络。
A亚型的多样性与临床意义
A型血并非单一同质群体,目前已发现超过20种亚型,其中A1和A2亚型占临床病例的99%以上。A1亚型的红细胞表面同时存在A和A1抗原,而A2亚型仅表达A抗原,这种差异源于两种亚型糖基转移酶活性的不同。研究显示,A1细胞的A抗原密度比A2细胞高出5-10倍,这种量的差异直接导致血清学检测中凝集强度的显著区别。例如,使用单克隆抗A试剂时,A1细胞通常呈现强凝集(4+),而A2细胞仅表现为中等强度凝集(2+)。
亚型差异对临床输血具有深远影响。约1-2%的A2型个体血清中会产生抗A1抗体,这可能导致交叉配血不合或溶血反应。2017年开封市中心医院的案例显示,一名类B抗原干扰的A2型患者因抗原表达异常被误判为AB型,最终通过酸化实验和分子检测确认其真实血型,避免了潜在的输血风险。此类事件凸显了亚型检测在精准医疗中的必要性,特别是在器官移植和新生儿溶血病防治领域。
A抗原的生物学功能与应用
作为重要的细胞表面标志物,A抗原在免疫识别中扮演双重角色。一方面,它通过介导红细胞与血清抗体的特异性结合参与免疫防御;异常的A抗原表达可能引发自身免疫性疾病。日本学者山本等发现,A抗原的糖链结构可与某些肠道细菌的荚膜多糖发生分子模拟,这种交叉反应可能是ABO血型与传染病易感性关联的分子基础。例如,A型个体对霍乱弧菌的感染风险较O型人群更高,这与其抗原结构的相似性密切相关。
在医学实践中,A抗原的检测技术不断革新。传统的血清凝集法正逐渐被基因分型和质谱分析取代,后者能准确区分A亚型及孟买血型。2022年《红细胞血型抗原结构与功能》研究指出,基于糖链生物标志物的液态活检技术,可通过检测血浆中脱落的A抗原片段实现早期癌症筛查,为血型研究开辟了新的临床应用方向。在法医学领域,A抗原的群体分布特征已成为种族迁移研究和亲子鉴定的重要参考,例如北欧人群A型占比超过40%,而东亚地区则呈现O型主导的分布特点。

A型血所携带的A抗原,不仅是红细胞膜上的生物标志物,更是连接遗传学、免疫学和临床医学的重要桥梁。从分子结构的精确解析到亚型鉴定的技术创新,从输血安全的保障到疾病机制的探索,对A抗原的深入研究不断推动着生命科学的发展。未来研究可聚焦于三个方向:一是开发高灵敏度的床边快速亚型检测设备,二是探索ABO血型与肿瘤微环境的相互作用机制,三是利用基因编辑技术调控抗原表达以解决器官移植排斥难题。这些探索将进一步提升人类对血型系统的认知深度,为精准医疗提供更强大的理论支撑。


