人类ABO血型系统的核心差异源于红细胞表面抗原的糖链结构。A型血并非单一类型,而是存在A1、A2等亚型的分化。这种分化源于控制抗原合成的基因突变和酶活性的差异。研究表明,A型抗原的分子基础是红细胞表面糖脂末端连接的N-乙酰半乳糖胺,而A1亚型与A2亚型的区别在于抗原表位密度和空间构象的不同。例如,A1型红细胞每个细胞表面约含81万-117万个A抗原位点,而A2型仅有24万-29万个,这种数量差异导致两者在血清学检测中呈现不同的凝集强度。
从遗传学角度看,ABO基因座上的等位基因突变是亚型形成的根本原因。现代分子生物学研究显示,A1型由正常的A基因(A101等位基因)控制,而A2型则源于基因外显子6的C467T突变,该突变导致糖基转移酶的活性降低约30%。这种微小的遗传差异,通过影响抗原合成的效率,最终在红细胞表面形成抗原密度的显著差异,构成了A型亚型的生物学基础。
二、血清学检测中的亚型鉴别
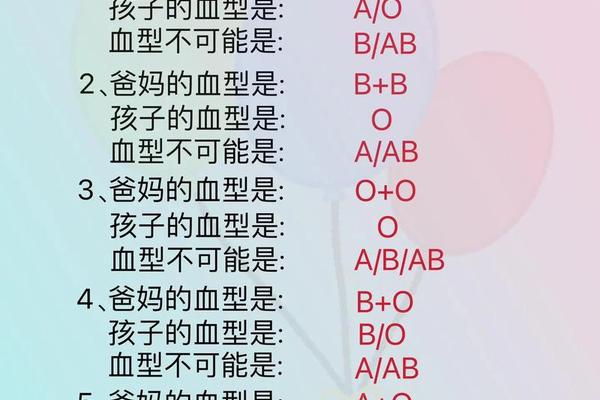
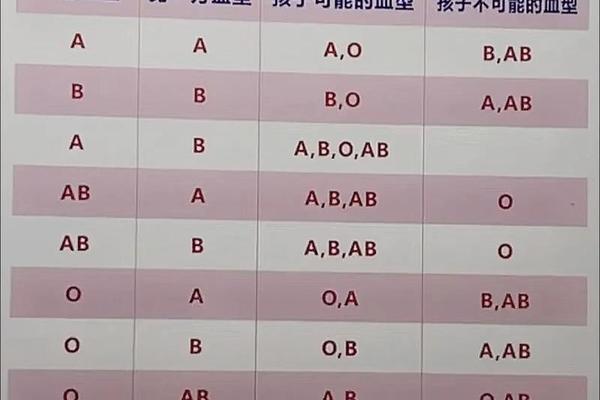
在临床实践中,A型亚型的鉴别依赖特异性抗体的凝集反应。常规血型检测使用抗A1抗体(如Dolichos biflorus凝集素)进行亚型区分:A1型红细胞会与抗A1发生强凝集,而A2型仅呈现弱反应或不反应。这种差异化的凝集模式为临床输血安全提供了重要依据。例如,约1%-8%的A2型个体血清中可能含有抗A1抗体,若输入A1型血液可能引发溶血反应。
更精细的亚型鉴别需要分子检测技术。基因测序显示,目前已知的A型变异体超过20种,包括A3、Ax、Ael等罕见亚型。这些亚型在常规血清学检测中常表现为混合视野凝集或弱反应,容易误判为O型。例如Ax型红细胞仅与部分单克隆抗A试剂反应,其分子机制是基因外显子7的突变导致酶活性部分丧失。这类发现推动了血型检测从表型分析向基因分型的技术革新。
三、临床输血与器官移植的影响
A型亚型的差异直接影响临床输血策略。统计显示,A2型供血者约占A型人群的20%,其红细胞因抗原密度较低,在紧急情况下可有限输注给O型患者。但这种异型输血存在剂量限制——当输注量超过1单位时,供者血浆中的抗B抗体可能引发受者溶血反应。在器官移植领域,供受体间的亚型不匹配可能导致抗体介导的排斥反应。研究证实,A2型肾脏移植给O型受体的成功率比A1型高15%,这与其较弱的抗原表达密切相关。
对于新生儿溶血病的预防,亚型检测具有特殊价值。若母亲为O型而胎儿为A2型,因A2抗原免疫原性较弱,发生HDN的概率比A1型降低60%。这一发现促使部分国家将产前亚型筛查纳入常规孕检项目,通过分子诊断技术提前评估溶血风险。
四、群体遗传学与人类学研究
A型亚型的全球分布呈现显著的地域特征。基因频率分析显示,A2型在欧洲人群中的比例高达35%,而在东亚人群中不足5%。这种差异可能与传染病选择压力相关:疟疾流行区A型人群的基因频率普遍较低,但A2型在非洲疟疾区的相对优势提示其糖链结构可能影响疟原虫的侵袭效率。在人类迁徙研究中,A亚型的分布模式为追溯民族迁移路线提供了分子标记。例如美洲原住民中A型几乎全为A1型,这与欧亚大陆的基因多样性形成鲜明对比,支持美洲原住民的单次迁移假说。
五、未来研究方向与技术突破
当前研究前沿聚焦于三方面:一是开发第三代基因编辑技术精确调控抗原表达,2024年中国学者已实现在体外培养红细胞中定向编辑ABO基因;二是建立全球血型数据库,通过机器学习预测稀有血型的区域分布;三是探索血型抗原在肿瘤免疫中的新功能,最新临床试验显示A型抗原可作为结直肠癌免疫治疗的生物标志物。
合成生物学为血型研究开辟了新路径。2025年初,日本团队成功构建人工合成H抗原载体,通过体外酶促反应将O型红细胞转化为A2型,转化效率达到临床适用标准。这项突破不仅解决了稀有血型供应难题,更揭示了血型抗原可塑性的生物学本质。
A型血内部的精细分化,既是自然选择的遗传印记,也是医学进步的技术路标。从兰德施泰纳发现ABO血型至今,人类对血型系统的认知已从表型观察深入到分子机制。未来随着单细胞测序和合成生物学的突破,血型研究将跨越输血医学的传统边界,在疾病防控、免疫治疗乃至人类进化研究等领域展现更广阔的应用前景。建议加强跨学科合作,建立血型分子诊断的国际标准,同时开展公众科普消除对"熊猫血"等特殊血型的社会偏见,让血型科学真正服务于人类健康共同体。


