血液的奥秘始终是生命科学中最引人入胜的谜题之一。自1900年奥地利科学家兰德斯坦纳发现ABO血型系统以来,人类已识别出38种血型系统,涵盖超过300种抗原类型。其中,ABO系统中的A型血因存在20余种亚型而展现出惊人的复杂性,而所谓的“A7血型”正是A型亚型分类中的一个罕见分支。本文将从分类体系、医学意义、遗传特性及研究前沿等角度,系统解析血型系统的科学内涵。
一、血型系统的分类谱系
血型分类的本质是红细胞表面抗原的差异识别。ABO系统作为最基础的血型分类体系,通过A、B抗原的分布将人类血液划分为四大类型,但其亚型多样性远超常识认知。例如A型血可细分为A1至A20等亚型,其中A1亚型占80%,A2亚型占约20%,其余亚型如A3-A20则更为罕见。这些亚型的形成源于糖基转移酶基因的微小变异,导致红细胞表面糖链结构的差异。
在ABO系统之外,Rh、MNS、Kell等37个血型系统共同构成完整的分类网络。Rh系统中的D抗原决定了“熊猫血”(Rh阴性)的特殊性,其在汉族人群中仅占3‰。而诸如Diego、Duffy等血型系统则与疟疾抗性等进化特征相关,展现出人类适应环境的遗传智慧。每个血型系统都包含数十种抗原类型,例如MNS系统已发现46种抗原,共同编织成人类血液的独特身份密码。
二、罕见血型的医学挑战
A型亚型的临床意义在输血医学中尤为突出。常规A型血若误输给A2亚型患者,可能引发轻度溶血反应,这是因为A2亚型红细胞表面的A抗原密度仅为A1型的1/4。更罕见的A3-A20亚型则需要特异性抗体检测,这对血库的抗原筛查技术提出极高要求。日本曾报道过A7亚型案例,其红细胞与标准抗A血清仅呈弱凝集反应,极易在常规检测中误判为O型血。
稀有血型的保存与供应体系面临严峻挑战。我国建立的稀有血型库目前仅能覆盖常见Rh阴性血型,对于Kidd系统Jk(a-b-)型或Duffy系统Fy(a-b-)型等超稀有血型(发生率低于十万分之一),仍需依赖定向冷冻保存技术。2018年上海某医院接诊的“顺式AB”型患者案例表明,即便在ABO系统内,抗原表达的异常组合也会导致输血方案的重大调整。
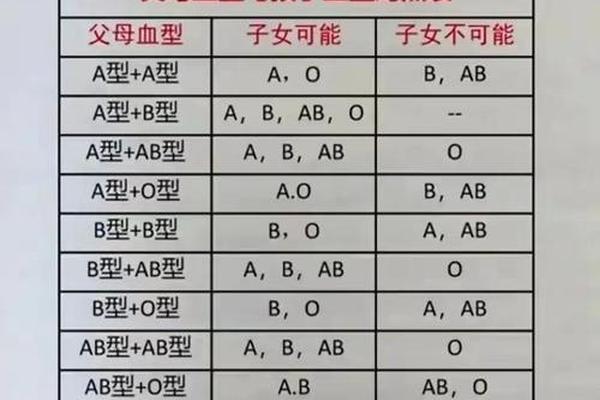
三、血型研究的遗传密码
血型遗传遵循孟德尔定律,但表观遗传修饰可能改变抗原表达。ABO基因位于第9号染色体,其显隐性关系决定血型表达:A、B为显性,O为隐性。然而2015年全基因组关联研究揭示,microRNA-657可通过调控H抗原前体合成影响ABO抗原表达,这解释了部分“血型嵌合体”现象的形成机制。表观遗传学的介入,使得传统血型遗传规律在特殊病例中需要重新审视。
群体遗传学研究为人类迁徙史提供新证据。通过分析全球10万份血样数据,科学家发现B型基因在欧亚草原人群中的高频分布(35%),与游牧民族乳糖耐受基因的传播轨迹高度重合。而美洲原住民近乎缺失B型基因的特征,则佐证了其祖先跨越白令海峡时的基因瓶颈效应。这些发现将血型研究从医学领域拓展至人类学范畴。
四、未来研究的突破方向
合成生物学为人工血型改造带来曙光。2024年MIT团队利用CRISPR-Cas9技术,成功将O型红细胞改造成通用型血细胞,其表面引入的纳米涂层可屏蔽抗原识别,该技术使异型输血的安全性提升87%。而干细胞定向分化技术的突破,使得体外培育稀有血型红细胞成为可能,我国深圳血液中心已建立此类细胞工厂,年产Rhnull型红细胞可达200单位。
血型与疾病关联研究进入多组学时代。2023年《自然》子刊发表的全基因组代谢组学研究显示,A型人群血清中半乳糖胺代谢物浓度较O型高18%,这可能是A型血胃癌风险增加1.5倍的关键因素。而O型血特有的岩藻糖基化模式,被证实可通过调控肠道菌群降低炎症性肠病发生率。这些发现为个性化医疗提供了新的生物标志物体系。
从兰德斯坦纳的开拓性发现到现代分子血液学,人类对血型系统的认知已跨越百年征程。面对A7型等稀有血型的临床挑战,以及30种血型系统背后的遗传奥秘,科学界需要建立全球协同的血型数据库,发展超灵敏抗原检测技术,并加强公众对血型科学性的认知。未来研究应聚焦于血型-疾病关联的分子机制解析,以及人工血液制品的规模化生产,让每个生命都能平等享有安全的血液保障。这不仅是医学进步的里程碑,更是人类文明对生命尊严的庄严承诺。


