血型作为人体最基础的遗传标记之一,长期以来被视为稳定不变的生物学特征。医学史上偶有报道的“血型突变”案例,如A型血患者突然检测出B型特征,或B型血在特定条件下呈现A型反应,引发了公众对血型稳定性的质疑。这种看似违背遗传规律的现象背后,究竟是检测误差、病理干扰,还是真正的基因突变?科学界通过临床观察与分子生物学研究,逐渐揭开了血型可塑性背后的复杂机制。
一、血型变化的科学基础
ABO血型系统的本质是红细胞表面抗原的差异。A型血的红细胞携带A抗原,B型血携带B抗原,这两种抗原均由糖链结构修饰而成,其末端的糖基差异决定了抗原特异性(如A抗原末端为N-乙酰氨基半乳糖,B抗原为半乳糖)。正常情况下,这些抗原的表达由9号染色体上的ABO基因永久性调控,因此血型终生稳定。
某些病理或外源性因素可能干扰抗原表达。例如细菌感染时,特定酶类可能将A抗原末端的乙酰基去除,使其结构趋近B抗原,形成“获得性B”现象。这种暂时性改变仅影响抗原表型,不涉及基因层面的突变,当病原体清除后,血型可恢复原状。类似地,白血病等恶性血液疾病可能抑制糖基转移酶活性,导致抗原表达减弱或异常,造成检测结果偏差。
二、临床案例中的血型异变
2006年青岛鲁老汉的案例极具代表性。该患者首次输血时被判定为B型,两天后复查却显示A型特征,最终经唾液抗原检测确认为罕见的AB亚型。这类亚型因抗原表达不完全,常规血清学检测可能误判。例如AB3亚型在健康状态下仅表达微弱B抗原,易被判定为A型;而当机体因创伤或感染出现应激反应时,B抗原表达增强,导致检测结果“突变”。
更根本性的改变见于造血干细胞移植。当供者与受者ABO血型不合时,移植成功后受者的血型将完全转变为供者类型。这是因为中的造血干细胞被彻底替换,新生成的红细胞完全携带供者抗原。例如2016年重庆某白血病患者接受O型供体干细胞移植后,其血型永久转为O型,原有B型特征消失。这类变化属于基因层面的“替换”而非突变,是当前血液病治疗中的常规现象。
三、检测误差与认知误区
技术局限性常被误认为血型突变。2016年陕西商洛医院将B型患者错输A型血,事故根源在于未严格执行双人核对制度,血袋标签信息缺失导致床号混淆。这类人为失误暴露出基层医疗机构在输血管理中的漏洞,与血型生物学改变无本质关联。
另一类误差源于特殊生理状态。婴幼儿免疫系统未发育完全,抗体效价低,可能出现血型鉴定模糊;老年人或恶性肿瘤患者因抗原衰减,正反定型结果矛盾。例如部分晚期癌症患者的A抗原表达量降至检测阈值以下,可能被误判为O型,但这并非真正的血型改变。
四、遗传学视角的再审视
真正的ABO基因突变极为罕见。研究表明,ABO位点的自发突变率低于百万分之一,且多数突变导致无效等位基因(如A→O),鲜少发生A/B互变。2014年《自然》杂志报道的南非家族性B→A突变案例,经全基因组测序发现是9号染色体复杂重排导致B基因部分缺失,同时激活了沉默的A等位基因,这种极端情况在普通人群中几乎不存在。
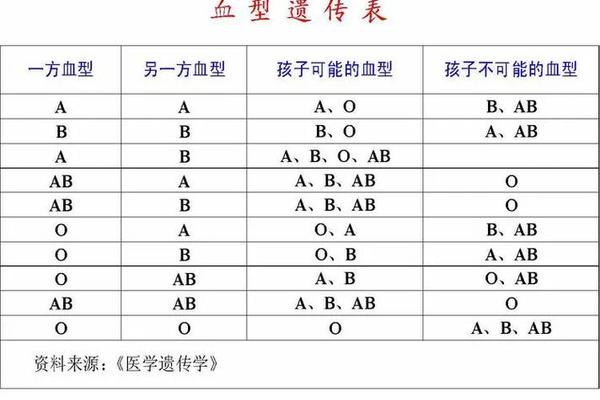
从群体遗传学看,ABO血型分布遵循哈迪-温伯格平衡。数学建模显示,当父母均为O型时,子女必为O型;若出现“O型父母生出A/B型子女”,更可能源于非生物学亲子关系而非基因突变。这解释了为何民间传言中的“血型突变”常伴随家庭争议,而基因检测往往揭示出更深层的社会学因素。
五、未来研究方向
当前研究空白主要集中在获得性血型改变的分子机制。例如类B抗原的具体合成途径、白血病相关基因如何干扰糖基转移酶活性等,仍需单细胞测序技术的突破。临床层面,建立动态血型数据库至关重要,尤其对接受干细胞移植、放化疗的患者进行终身血型监测,可避免输血事故。
公众科普亦需加强。2020年调查显示,38%的民众误认为血型会自然改变,这种认知可能导致输血治疗中的依从性下降。医疗机构应通过标准化检测流程(如正反定型联合分子检测)提升结果准确性,同时开展血型遗传学教育,消除公众误解。
血型的变化本质上是抗原表达与基因型关系的复杂映射。绝大多数所谓的“突变”实为检测误差、病理干扰或抗原表型修饰所致,真正的基因突变概率微乎其微。现代医学通过分子诊断技术与临床监测体系的完善,已能精准区分这些状况。对于公众而言,理解血型稳定的生物学基础,同时认知特殊情境下的可塑性,既是科学素养的提升,也是对生命复杂性的敬畏。未来研究应聚焦于血型抗原调控网络解析,这将为输血医学、器官移植乃至疾病治疗开辟新的可能性。


