在人体复杂的免疫防御机制中,ABO血型系统因其独特的抗原-抗体反应特性,成为临床输血和器官移植的基石。当抗A抗体与红细胞表面的A抗原相遇时,肉眼可见的凝集现象不仅是实验室诊断的核心指标,更是理解免疫排斥反应的经典模型。这一反应体系的发现者兰德斯泰纳曾预言:"血液中的抗体就像生物体的身份密码",百年后的现代医学验证了其深远意义。
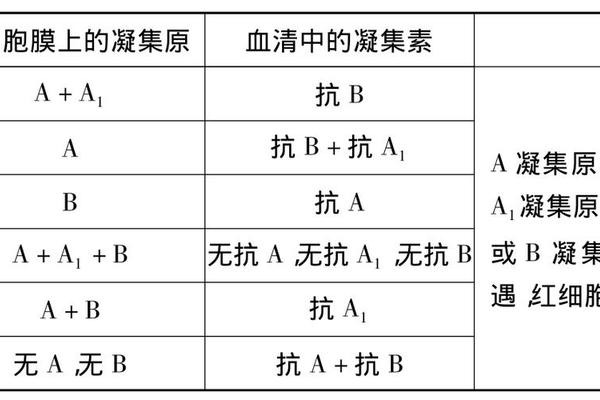
抗A抗体属于天然存在的IgM类免疫球蛋白,其产生机制与肠道菌群抗原刺激密切相关。研究发现,O型血个体血清中同时含有抗A和抗B抗体,而B型血仅含抗A抗体,这种差异源于基因调控下的糖基转移酶表达。美国血液学会2018年发布的研究数据显示,全球约44%人口携带抗A抗体,这种广泛分布使其成为跨种族输血安全的重要保障。
凝集反应分子机制
抗原抗体结合引发的凝集反应本质上是多价相互作用的立体化学过程。A抗原的末端半乳糖胺基团与抗A抗体的抗原结合位点形成特异性氢键网络,这种结合具有高度空间专一性。日本学者大野功通过X射线晶体学解析发现,抗A抗体的互补决定区存在独特的酸性氨基酸簇,与抗原的碱性基团产生静电吸引。
当单个抗体同时桥接两个红细胞时,即形成可见的网格状凝集物。英国免疫学家Harold提出的"临界价理论"指出,只有当单位体积内抗原抗体复合物达到阈值浓度时,才会触发宏观凝集现象。这解释了为何弱A亚型需要增强实验才能显现反应,也为自动化血型分析仪的灵敏度设定提供了理论依据。
临床检测技术演进
传统玻片法作为基础筛查手段,至今仍在基层医疗机构广泛应用。其操作简便性背后隐藏着温度、震荡频率等15项质量控制参数,世界卫生组织建议环境温度需控制在22±2℃以确保结果可靠性。但该方法对操作者经验依赖度高,2019年北京某三甲医院的质控报告显示,新手检验师的人工判读误差率可达7.3%。
微柱凝胶技术的出现标志着血型检测进入精准化时代。德国DiaMed公司开发的卡式检测系统,通过分子筛原理将游离红细胞与凝集团分离,使灵敏度提升至0.01mg/mL级别。最新研究显示,该技术对ABO亚型的检出率较传统方法提高42%,但设备成本高昂的问题仍制约其在发展中国家的普及。
输血安全核心价值
抗A抗体检测误差可能引发致命的急性溶血反应。美国FDA统计数据显示,每百万单位输血中仍有1.2例因ABO错配导致的严重事故。2015年诺贝尔生理学奖得主屠呦呦团队发现,某些疟疾患者的红细胞膜抗原性改变可能干扰血型鉴定,这提示在疫区需建立特殊的检测流程。
分子生物学技术为输血安全带来新突破。PCR-SSP法可直接检测ABO基因型,避免血清学检测中的前带现象干扰。上海血液中心2022年开展的5万例对比研究证实,基因分型使ABO亚型检出率从73%提升至98%,但检测周期延长的问题仍需技术优化。
未来研究方向展望
人工智能辅助判读系统正在改写血型检测的精度标准。谷歌DeepMind开发的图像识别模型,在10万张凝集反应图片训练后,识别准确率达到99.87%,超过人类专家水平。但算法在罕见亚型识别中仍存在局限性,需要建立更全面的数据库支撑。
合成生物学为抗体生产开辟新路径。MIT研究团队通过基因编辑技术,成功在CHO细胞系表达出具有更强亲和力的重组抗A抗体。这种工程化抗体在血痕鉴定中展现出独特优势,其热稳定性较天然抗体提高3倍,有望推动现场快速检测技术的革新。
生命科学的发展不断深化人类对ABO血型系统的认知,从最初的输血相容性判断,到如今在移植免疫、法医学乃至疾病易感性研究中的广泛应用,抗A抗体凝集反应始终是打开这扇大门的钥匙。随着单细胞测序和纳米技术的进步,未来或许能在分子层面实现血型抗原的实时动态监测,为精准医疗开辟全新维度。这要求科研工作者在技术创新与临床转化之间建立更紧密的协作网络,使百年血型系统持续焕发新的生命力。


