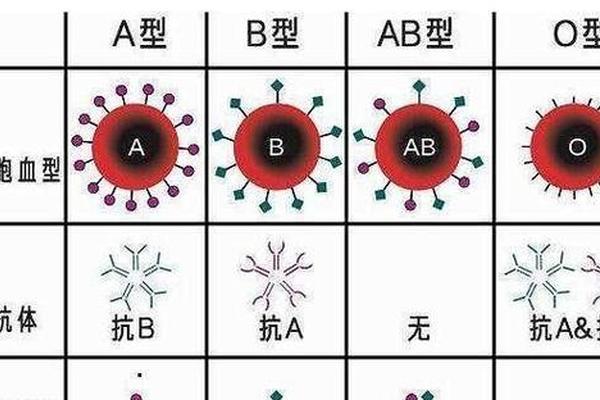
A型血的分型核心在于红细胞表面抗原的差异,其中A1和A2是ABO血型系统中最重要的亚型。根据ABO血型系统的定义,A型血个体的红细胞表面携带A抗原,但其抗原的表达量和结构在不同亚型中存在显著差异。A1亚型红细胞同时表达A抗原和A1抗原,而A2亚型的红细胞仅携带A抗原,且抗原密度较A1型低约20%-50%。这种差异源于编码糖基转移酶的基因突变:A1型由显性基因控制,能催化H抗原转化为A抗原并合成A1特异性抗原;A2型则因基因突变导致酶活性不足,无法形成A1抗原,同时H抗原的表达量反而高于A1型。
从分子结构来看,A1抗原的糖链末端比A2型多一个N-乙酰氨基半乳糖,这种化学结构的微小差异导致两者在血清学反应中的表现截然不同。例如,A2型个体的血清中可能含有抗A1抗体,而A1型血清仅含抗B抗体。这种抗原-抗体的特异性反应是区分A1和A2亚型的关键依据,也解释了为何A2型易被误判为O型或B型。
血清学检测的临床挑战
在临床血型鉴定中,A1和A2的区分依赖于抗A1凝集素的使用。A1型红细胞会与抗A1抗体发生强凝集反应,而A2型则无此反应。A2亚型的低抗原表达可能造成检测误差。例如,使用常规抗A试剂时,A2型红细胞因抗原数量不足,可能仅显示微弱凝集甚至不凝集,从而导致误判为O型。A2B型个体的红细胞抗原更弱,可能被误判为B型,这对输血安全构成潜在风险。
国际输血协会的数据显示,全球约1%-8%的A型人群属于A2亚型,但不同种族分布差异显著。例如,非洲人群的A2亚型比例高达20%-35%,而亚洲人群不足1%。这种地域差异要求临床检测需结合人群特征调整灵敏度,例如采用增强型抗A1试剂或分子生物学检测技术。
遗传学机制与进化意义
A亚型的形成与ABO基因的突变密切相关。A1亚型由正常的A等位基因(IA)控制,而A2亚型则源于该基因第7外显子的单核苷酸缺失(c.1061delC),导致糖基转移酶结构改变,催化效率降低。这种突变属于中性进化选择的结果,可能与病原体压力有关。例如,某些疟原虫通过识别A抗原感染红细胞,而A2亚型因抗原表达较弱,可能赋予宿主部分抗疟优势。
从遗传规律看,A1和A2亚型遵循显性遗传模式。若父母一方为A1型(基因型IA1),另一方为A2型(基因型IA2),子代有50%概率为A1型,50%为A2型。由于A2型抗原表达较弱,部分遗传学检测需结合唾液中的A物质分泌状态或基因测序才能准确判定。
输血医学中的实践意义
A亚型的精准分型对输血安全至关重要。若将A2型供血误输给A1型受血者,供血红细胞可能被受血者的抗A1抗体破坏,引发急性溶血反应。反之,A2型受血者若接受A1型血液,同样可能因抗原-抗体反应导致输血风险。国际输血指南建议:对A亚型患者应输注同亚型血液,紧急情况下可选择O型红细胞和AB型血浆的组合。
A亚型与器官移植的相容性亦存在关联。研究显示,A2型供体的肾脏移植给O型受体的排斥反应发生率较A1型低17%,这可能与A2抗原的弱免疫原性有关。这一发现为异型移植提供了新的研究方向。
未来研究与临床展望
尽管A亚型分型技术已取得显著进展,但仍存在未解难题。例如,Ax、A3等罕见亚型的分子机制尚未完全阐明,其临床意义需进一步探索。基因编辑技术的突破为人工调控抗原表达提供了可能,未来或可通过CRISPR技术修饰糖基转移酶基因,实现血型的人为改造。
在公共卫生层面,建立全球性的A亚型数据库有助于优化血源分配策略。例如,在A2亚型高发地区储备专用血液制品,可减少因误判导致的医疗风险。开发快速检测试剂盒和自动化分型设备,将进一步提升临床检测效率和准确性。
总结
A型血的A1和A2亚型分化,是抗原表达、遗传变异与临床实践交织的复杂现象。从分子结构到血清学反应,从遗传规律到输血安全,精准分型的必要性贯穿始终。随着基因测序技术的普及和免疫学研究的深入,A亚型的临床管理将更加精细化。未来的研究需聚焦罕见亚型的病理机制,并推动分型技术向高通量、低成本方向发展,最终实现个体化输血治疗的全面升级。


