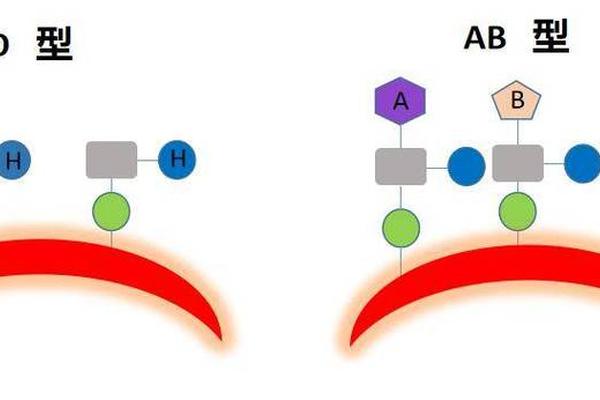
孟买血型的核心特征在于其独特的遗传缺陷——H抗原的完全缺失。这种血型由位于19号染色体上的FUT1基因隐性突变引发,表现为基因型hh。H抗原是ABO血型系统的基础,所有ABO抗原(A、B、O)均需在H抗原的糖链结构上修饰形成。孟买型个体的红细胞既无H抗原,也无法通过A/B基因表达A或B抗原,其血清中则存在抗A、抗B及强效抗H抗体。
值得注意的是,类孟买血型作为孟买型的亚型,其遗传机制更为复杂。类孟买型个体携带部分抑制H基因表达的调节基因(如zz型),导致红细胞表面仅有微量H抗原,这些H抗原可被A或B基因转化为少量A/B抗原。例如,类孟买A型个体的红细胞在常规检测中可能被误判为O型,但通过唾液检测可发现A抗原分泌,基因测序则能确认其携带A基因。这种特性使得类孟买型成为连接ABO系统与Hh系统的关键研究对象。
ABO血型与孟买型的关联性
ABO血型与孟买型的关系本质上是糖链修饰的级联效应。在正常ABO血型中,H抗原作为前体物质,经A/B基因编码的转移酶催化形成A/B抗原;而孟买型因缺乏H抗原,阻断了这一生化路径。例如,一个基因型为AA的孟买型个体,尽管携带A基因,却无法在红细胞表面表达A抗原,其ABO表型仍为“伪O型”。
类孟买型的特殊性在于其部分保留了H抗原的转化能力。研究表明,类孟买A型个体的红细胞表面可检测到约1%的正常A抗原水平,这些抗原足以在特定检测条件下显现。这种微弱的抗原表达解释了为何类孟买型易被误诊为O型,同时也揭示了ABO系统与Hh系统在分子层面的深度关联。例如,2024年江西发现的全球首例类孟买B型新等位基因(FUT1 c.696G>C),进一步证明了H抗原修饰能力的遗传多样性。
临床检测的挑战与解决方案
常规ABO血型检测对孟买型存在严重局限性。由于红细胞缺乏A/B抗原,孟买型在正定型中表现为O型,而反定型则因血清中含抗H抗体与O细胞反应,导致结果矛盾。2013年湖南发现的类孟买A型案例中,患者正反定型差异曾引发检测困惑,最终通过唾液抗原检测和基因测序才得以确诊。
为突破这一技术瓶颈,现代输血医学采用多维度检测策略。首先通过抗H抗体排除O型可能性,随后利用唾液中和试验检测分泌型抗原,最后通过基因测序确认FUT1突变位点。例如,2022年深圳罗湖医院通过将“自身细胞对照”改为“O细胞对照”,显著提高了类孟买型的检出率。这些方法的应用使得我国类孟买型确诊案例从2013年的不足30例增至2024年的近百例。
输血医学中的应对策略
孟买型患者的输血安全依赖于精准的血型匹配。由于抗H抗体可在4-37℃范围内激活补体,输入含H抗原的血液(包括O型)会引发致命性溶血反应。2020年上海第六人民医院的案例中,医生通过筛选37℃下无反应的B型血液,配合输血时保温措施,成功规避了抗H抗体的破坏作用。
自体输血和稀有血型库建设是当前的核心解决方案。内蒙古自治区血液中心通过冰冻保存技术,将类孟买型红细胞的有效期延长至10年;深圳则建立了包含近万名稀有血型信息的数据库。对于无法获得同型血液的紧急情况,研究表明类孟买A型患者可输注经严格交叉配血的A型红细胞,但需确保输入血液在37℃环境中维持抗原稳定性。
未来研究方向与临床应用
基因编辑技术为孟买型研究提供了新思路。2024年江西发现的FUT1新突变位点(c.696G>C)被国际基因库收录,这不仅完善了人类血型遗传图谱,也为靶向修复H抗原合成通路奠定了基础。诱导多能干细胞(iPSC)分化技术有望实现体外生产孟买型红细胞,从根本上解决血液供应难题。
在临床层面,建立全国性稀有血型联盟迫在眉睫。目前,我国类孟买型登记人数不足百例,地域分布高度分散。专家建议将基因检测纳入新生儿筛查项目,同时通过公众科普提高稀有血型个体的自我保护意识。例如,山东某案例中,一对兄妹同时确诊类孟买型,凸显家族基因筛查的重要性。
总结
孟买血型仿A及ABO血型与孟买型的关联性研究,揭示了人类血型系统的复杂性与进化智慧。从分子机制上看,H抗原的缺失重塑了ABO抗原的表达逻辑;从临床实践看,多维度检测技术与个性化输血方案显著提升了救治成功率。未来,随着基因测序成本的降低和血型数据库的完善,我们有理由相信,稀有血型患者将获得更精准的医疗支持。这一领域的研究不仅关乎输血安全,更是探索人类遗传多样性的重要窗口。


