在ABO血型系统中,A抗原作为红细胞表面的关键标志物,其与抗A抗体的相互作用是免疫反应的核心。A型血个体的红细胞表面存在A抗原,而B型或O型个体的血清中天然携带抗A抗体。当A抗原与抗A抗体相遇时,这种特异性结合会触发红细胞的凝集反应,这一现象不仅是输血医学的基础,也是理解免疫排斥、新生儿溶血等临床问题的关键。本文将从分子结构、凝集机制、临床影响及研究挑战四个维度,系统解析这一生物学现象。
抗原与抗体的分子基础
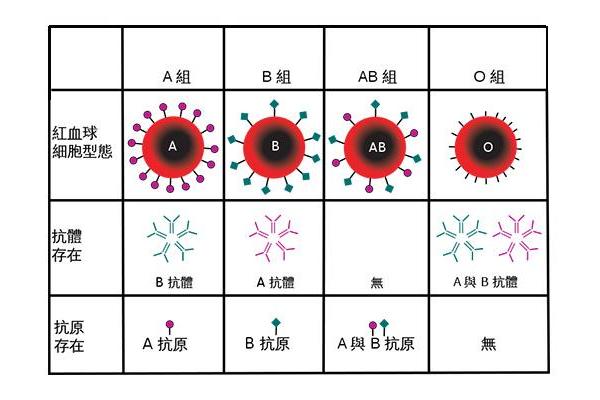
A抗原的分子本质是糖基化修饰的鞘糖脂,其核心结构由H抗原前体延伸形成。基因调控的糖基转移酶决定了抗原特异性:A基因编码的N-乙酰半乳糖胺转移酶将H抗原转化为A抗原,而B基因则催化形成半乳糖末端结构。这种糖链末端的微小差异(如A型与B型仅相差一个羟基)成为抗体识别的关键位点。
抗A抗体属于IgM和IgG类免疫球蛋白,其结合位点通过互补结构与A抗原的糖基形成氢键、疏水作用等非共价结合。天然抗A抗体(IgM)存在于非A型个体中,通过环境微生物的交叉免疫刺激形成。例如,某些肠道细菌的糖链结构与A抗原相似,使机体误将其识别为异源物质,从而产生免疫记忆。这种分子层面的“锁钥关系”解释了抗体的高度特异性——即使抗原存在微小变异(如A1与A2亚型),也会显著影响结合强度。
凝集反应的发生条件
A抗原与抗A抗体的凝集反应受多重因素调控。在生理盐水中,IgM类抗A抗体因其五聚体结构可同时结合多个红细胞表面的A抗原,形成肉眼可见的凝集块。例如,标准抗A血清需在15秒内引发A1型红细胞的凝集,且3分钟时凝块直径需≥1mm²,这体现了亲和力与反应速率的平衡。但对于A2等弱亚型,因抗原密度较低,可能仅出现混合视野凝集甚至假阴性结果,需通过吸收放散实验验证。
温度与pH值亦影响凝集强度。IgM抗体的最适反应温度为4-24℃,而IgG抗体在37℃活性更高。临床血型鉴定中,A亚型的漏检风险常源于试剂抗体效价不足或反应条件偏差。例如,A2B型红细胞因抗原数量仅为A1B型的1/5,易被误判为B型。这提示标准化检测需同时采用正反定型法,并关注抗体的效价(≥1:128)和亲和力参数。
临床实践中的双重影响
在输血医学中,A抗原-抗A抗体的相互作用既是安全屏障也是潜在风险。ABO同型输血可最大限度避免溶血反应,但在紧急情况下,O型血(含抗A、抗B抗体)输注给A型患者时,若输入量超过2000ml,未被充分稀释的抗体仍可能引发迟发性溶血。更复杂的情况出现在器官移植领域,供受体ABO血型不合会导致超急性排斥,因其血管内皮细胞同样表达ABO抗原。
新生儿溶血病(HDN)是另一个典型例证。当O型母亲孕育A型胎儿时,母体IgG类抗A抗体可通过胎盘屏障,破坏胎儿红细胞。尽管发生率仅0.3%-0.6%,但第一胎即可能发病,这与传统Rh溶血机制不同。临床通过抗体效价监测(如效价≥1:64需干预)和产前免疫球蛋白注射可有效降低风险。
研究前沿与技术挑战
当前研究聚焦于A抗原的精细表位解析。通过噬菌体展示技术筛选的A抗原模拟多肽(如专利CN101096381B所述序列Tyr-Pro-Ser),为开发无细胞毒性的人工血型试剂提供了新思路。基因编辑技术则试图敲除H抗原基因,创建通用供体红细胞,但面临糖基转移酶网络调控复杂性的挑战。
在检测技术层面,微柱凝胶法的应用使弱A亚型检出率提升至99.9%,但成本与标准化仍是推广障碍。血型与疾病易感性的关联研究揭示:A型个体对诺如病毒、幽门螺杆菌的感染风险更高,可能与病原体利用ABO抗原作为受体有关。这为个性化医疗提供了新的生物标志物方向。
A抗原与抗A抗体的相互作用揭示了免疫系统精确识别与反应的分子逻辑。从基础的血型鉴定到复杂的临床决策,这一机制始终贯穿其中。未来研究需在三个方向突破:一是开发高灵敏度检测技术以应对日益复杂的亚型变异;二是探索ABO血型在肿瘤免疫、慢性疾病中的调控作用;三是通过合成生物学手段构建通用型红细胞,彻底解决血源短缺问题。唯有深入理解抗原-抗体的动态平衡,才能在精准医学时代实现更安全的输血治疗和更有效的疾病防控。


