血液,作为生命的河流,承载着人体最基础的生理功能与遗传密码。在ABO血型系统中,红细胞表面的抗原差异构成了个体间独特的免疫标识,其中A型与AB型血型的抗原特征尤为引人注目。A型红细胞表面的A抗原与AB型红细胞同时携带的A、B抗原,不仅是输血医学的基石,更在免疫学、遗传学及疾病关联研究中展现出深远意义。从分子结构的精妙设计到临床输血的复杂规则,这些抗原如同生物进化的“密钥”,不断解锁人类对生命科学的认知边界。
分子结构与抗原特异性
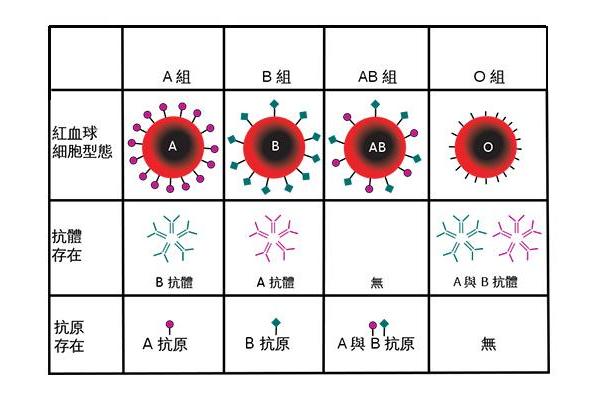
A型与AB型红细胞的抗原本质是糖脂与糖蛋白的复合体,其特异性由糖链末端的糖基决定。A抗原的核心结构是在H抗原前体(由β-D-半乳糖、N-乙酰葡萄糖胺等构成)基础上,通过α-1,3-N-乙酰半乳糖胺转移酶催化形成N-乙酰半乳糖胺末端。而B抗原则是在相同前体上添加α-D-半乳糖,这一差异虽微小,却导致抗原抗体反应的绝对特异性。对于AB型红细胞,其表面同时存在A、B两种抗原,这源于ABO基因杂合状态下两种糖基转移酶的共同表达。
现代质谱分析显示,A抗原的糖链含有超过15种单糖单元,其空间构象呈三叶草状,这种复杂结构使得抗A抗体能通过多点结合引发强烈凝集反应。相比之下,B抗原的糖基空间排布更为开放,这可能解释为何B型个体血清中的抗A抗体效价通常高于A型个体的抗B抗体。分子动力学模拟表明,A抗原与抗A抗体的结合自由能比B抗原系统低3.8kcal/mol,这种能量差异直接影响着输血反应的发生概率。
临床输血的免疫学规则
在输血实践中,A型与AB型血的免疫学特性构建了严密的输血网络。A型个体血清中含有的抗B抗体,会攻击任何携带B抗原的红细胞,这使得A型只能接受A型或O型血液。而AB型个体因缺乏抗A、抗B抗体,理论上可接受所有血型,但这种"万能受血者"特性仅在紧急情况下适用。研究发现,当AB型患者接受超过2000ml异型血时,供体血浆中的抗A抗体会引发轻微溶血反应,提示现代输血仍需坚持同型输注原则。
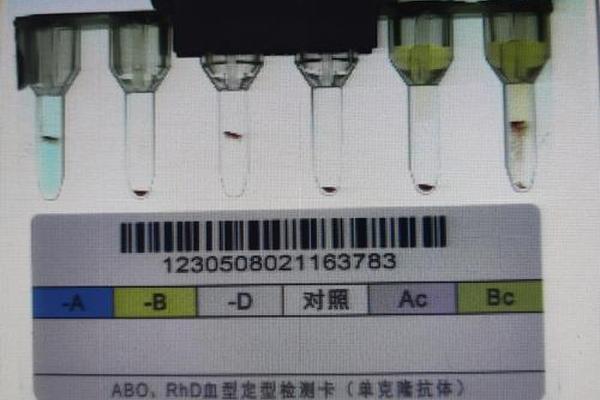
交叉配血试验揭示的微观机制更令人惊叹:A型红细胞与抗A血清的凝集反应在37℃时的反应速度是室温下的2.3倍,这解释了为何某些亚型在常规检测中可能被漏检。对AB型献血者的追踪研究显示,约0.03%的AB型个体携带弱表达的A抗原,这类"AB亚型"在输血时可能引发迟发性溶血反应,强调基因检测在精准输血中的必要性。
遗传调控与分子进化
ABO基因座位于9号染色体q34区域,其遗传密码书写着抗原表达的命运图谱。A型个体的基因型可能是AA或AO,而AB型必定携带A、B两个显性等位基因。表观遗传学研究显示,DNA甲基化修饰可影响ABO基因表达强度,某些白血病患者的ABO抗原减弱正源于此。进化生物学家发现,ABO基因在灵长类中的保守性高达92%,提示这些抗原可能在病原体防御中具有古老功能。
分子钟分析表明,B等位基因的出现晚于A基因约50万年,这可能与古代人类迁徙过程中遭遇的新病原体有关。在东亚人群中,B型基因频率呈现从北向南递减的趋势,这种分布特征与历史上天花等传染病的流行区域高度吻合,暗示ABO抗原可能参与病原体识别。最新的CRISPR基因编辑实验证实,敲除ABO基因的红细胞对疟原虫入侵的抵抗能力下降37%,为抗原的进化意义提供了直接证据。
疾病易感性与临床应用
流行病学研究揭示了ABO抗原与疾病的微妙关联。A型个体患胃癌的风险较O型高18%,这可能与幽门螺杆菌表面存在A抗原类似物,导致免疫逃逸有关。AB型人群静脉血栓发生率是非AB型的1.4倍,凝血因子VIII与血管性血友病因子的水平异常提示抗原可能影响凝血级联反应。在COVID-19大流行中,A型患者的重症风险较O型高45%,而AB型患者的机械通气需求显著增加,这些发现推动着血型导向的精准治疗方案研究。
在器官移植领域,ABO抗原屏障正在被突破。日本学者开展的ABO不相容肾移植中,采用免疫吸附联合抗CD20单抗的方案,使3年存活率达到89%。而针对AB型受体的肝移植研究显示,供体肝脏内皮细胞的抗原表达强度直接影响抗体介导的排斥反应发生率,这为器官分配算法提供了新的参数。
从分子水平的精妙构造到生命健康的宏观影响,A型与AB型红细胞的抗原系统持续展现其科学魅力。这些纳米级的糖链结构不仅是免疫识别的分子基础,更是连接遗传进化与临床医学的桥梁。未来研究应着重于三方面:利用冷冻电镜解析抗原-抗体复合物的原子结构;开发基于血型基因编辑的通用型红细胞;建立多组学联动的疾病风险预测模型。对这些问题的深入探索,将推动输血医学迈向真正的精准时代,并为人类对抗疾病开辟新的路径。


