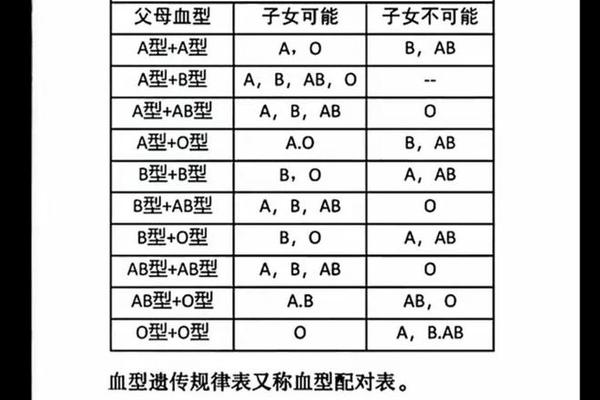
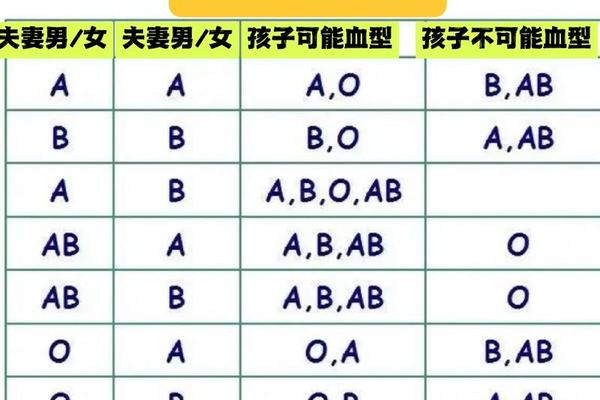
当孩子为A1血型时,父母的血型组合可能通过ABO血型系统的遗传规律影响新生儿溶血风险。根据ABO血型遗传学,A型血由显性基因A决定,而O型为隐性基因。若父母中一方为A型(基因型AA或AO),另一方为O型(基因型OO),则孩子可能遗传A基因并表现为A型血。若母亲为O型血,其体内天然存在的抗A抗体会通过胎盘进入胎儿循环系统,攻击携带A抗原的红细胞,引发ABO溶血反应。
值得注意的是,A1亚型是A型血的主要亚型,占A型人群的99%以上。其红细胞表面同时存在A和A1抗原,抗原表达强度显著高于其他A亚型(如A2)。当母体为O型且胎儿为A1型时,母体抗A抗体与胎儿红细胞的结合概率更高,导致溶血风险增加。研究显示,ABO溶血病例中,由抗A引发的占60%以上,且A1亚型引发的临床症状通常较其他亚型更为明显。
A1亚型的生物学特性与溶血关联
A1抗原的分子结构特点是其高溶血风险的关键因素。A1型红细胞表面不仅携带A抗原,还表达特异性A1抗原决定簇。这种抗原由N-乙酰半乳糖胺转移酶催化形成,其抗原表位密度是A2型红细胞的3-5倍。高密度的抗原表位使得母体抗A抗体更易识别并结合,进而激活补体系统,导致红细胞快速破裂。
从免疫学角度分析,A1抗原的强免疫原性可能引发母体二次免疫应答。即使初次妊娠未发生明显溶血,母体记忆性B细胞会在后续妊娠中产生更高浓度的IgG型抗A抗体。这类抗体分子量小,可自由通过胎盘屏障,造成胎儿红细胞持续破坏。临床数据显示,O型血母亲怀A1型胎儿时,二胎溶血发生率较一胎增加40%,且黄疸峰值出现时间提前至出生后12小时内。
溶血发生的病理机制解析
ABO溶血的核心机制是抗原-抗体复合物引发的红细胞破坏。当母体抗A抗体进入胎儿循环后,与A1抗原形成免疫复合物,激活经典补体途径。补体膜攻击复合物(MAC)在红细胞膜表面形成孔道,导致细胞内渗透压失衡而破裂。这种血管内溶血过程产生大量游离胆红素,超过胎儿肝脏代谢能力,从而引发高胆红素血症和核黄疸风险。
值得注意的是,A1亚型溶血具有独特的“双阶段损伤”特性。早期以急性血管内溶血为主,表现为血红蛋白急剧下降;后期因胆红素沉积导致神经细胞毒性损伤。动物实验表明,A1抗原刺激产生的抗体效价与溶血严重程度呈正相关,当抗体效价≥1:64时,新生儿需换血治疗的概率增加70%。A1抗原还可与胎盘组织中的类似抗原发生交叉反应,加剧胎盘功能异常,导致胎儿宫内发育迟缓。
诊断策略与临床干预进展
针对A1血型相关溶血的诊断,需结合血清学三联检测:直接抗人球蛋白试验(DAT)、游离抗体试验和红细胞抗体释放试验。其中释放试验的灵敏度高达95%,可检测到0.01μg/mL的致敏抗体,对A1亚型溶血的早期诊断具有关键价值。近年发展的分子诊断技术,如胎儿游离DNA分型,可在妊娠12周时通过母血检测胎儿ABO基因型,准确率达99.2%,大幅降低侵入性检测风险。
在治疗领域,双重换血疗法成为重症病例的首选方案。采用O型洗涤红细胞与AB型血浆按2:1比例输注,既可置换出致敏红细胞,又能补充白蛋白结合游离胆红素。临床数据显示,该方案使胆红素脑病发生率从12%降至2%以下。对于轻症患者,新型窄谱LED光疗设备可将胆红素代谢速率提升40%,同时减少皮肤灼伤等副作用。
总结与前瞻性建议
A1血型相关溶血的发生本质上是遗传特性与免疫应答相互作用的结果。父母血型组合中,O型母亲与A型父亲的组合风险最高,需从孕早期开始监测抗体效价。现有研究证实,产前母体免疫调节治疗(如静脉注射丙种球蛋白)可将中重度溶血发生率降低58%,但该方案对胎儿长期影响仍需更多循证医学证据支持。
未来研究方向应聚焦于三方面:一是开发针对A1抗原的特异性免疫抑制剂,阻断抗体-抗原结合的关键表位;二是建立全国性新生儿溶血病例数据库,通过机器学习模型预测个体化风险;三是探索基因编辑技术在ABO血型修饰中的应用可能性,从根源上消除血型不合引发的健康威胁。通过多学科协作,有望在下一个十年内将ABO溶血相关后遗症发生率控制在1‰以下。


