在医学检验领域,血型鉴定是确保输血安全、器官移植匹配及遗传学研究的基础性检测。抗A抗B抗体检测作为ABO血型系统的核心环节,通过分析血清中抗体与红细胞表面抗原的相互作用,揭示个体的血型特征。这项检测不仅涉及免疫学原理的深度应用,更直接影响临床决策的精准性。随着输血医学和分子生物学的发展,抗A抗B检测方法不断革新,但其核心逻辑始终围绕抗原抗体反应展开,成为连接基础科学与临床实践的重要桥梁。
一、血型系统的基本原理
ABO血型系统由红细胞表面抗原与血清中抗体的特异性对应关系构成。A型血的红细胞携带A抗原,血清中含抗B抗体;B型血携带B抗原,血清含抗A抗体;AB型血同时具有A、B抗原而无对应抗体;O型血缺乏A、B抗原但含有抗A、抗B两种抗体。这种抗原-抗体互补关系源于基因调控,A和B基因编码特异性糖基转移酶,分别催化H抗原转化为A或B抗原,而O基因则无法产生功能性酶,保留H抗原结构。
抗原抗体的空间构象决定反应特异性。抗A抗体通过Fab段与A抗原的半乳糖胺基结合,抗B抗体则识别B抗原的半乳糖基。这种分子识别具有高度专一性,即使在微量情况下也能引发可见的凝集反应。研究表明,抗原表位的微小差异可能导致亚型分化,例如A1与A2亚型的区别在于A抗原密度和糖链结构的细微差别,这对精准血型鉴定提出更高要求。
二、检测方法与操作规范
临床常用的抗A抗B检测包括正向定型和反向定型。正向定型使用标准抗血清(抗A、抗B)检测红细胞抗原,而反向定型则用已知A、B型红细胞检测血清抗体,二者结合可避免误判。玻片法操作简便,将受检者红细胞与抗血清混合后观察凝集,适用于大规模筛查;试管法通过离心加速反应,灵敏度更高,可识别弱抗原表达。现代凝胶微柱法则利用凝胶介质中的免疫反应,实现标准化检测和自动化判读。
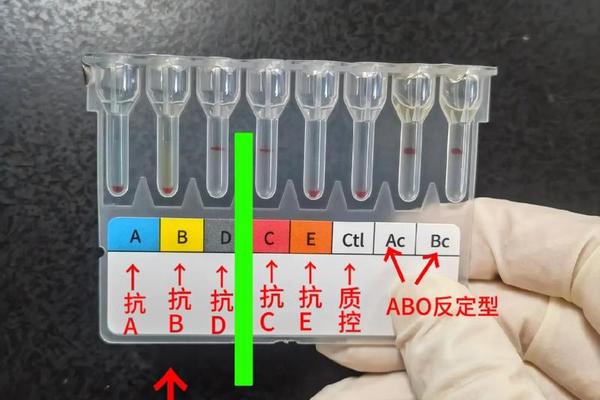
质量控制是检测可靠性的保障。标准抗血清需满足效价≥1:128,亲和力在15秒内引发凝集,且无交叉反应。操作时需注意温度控制(20-24℃),避免冷凝集干扰,对新生儿或老年人建议采用试管法增强灵敏度。临床案例显示,某医院曾遇冷凝集素干扰导致AB型误判,经37℃洗涤红细胞后修正为O型,凸显操作规范的重要性。
三、结果解读与临床意义
结果判读需结合凝集强度分级。强阳性(++++)表现为整片凝块,弱阳性(+)呈细沙状颗粒,混合视野(±)提示亚型或技术误差。例如抗A血清与红细胞出现+++凝集,抗B阴性,反向定型血清与B细胞凝集,可确诊为A型。特殊情况下,白血病患者的抗原减弱可能导致正反定型不符,需结合病史和增强试验综合判断。
临床应用涵盖输血安全、器官移植和母婴健康。在紧急输血中,O型红细胞因缺乏A/B抗原可作为"万能供体",而AB型血浆不含抗体适合作为"万能受者"。产科实践中,O型孕妇若携带IgG型抗A抗体,需监测抗体效价预防新生儿溶血,某研究显示抗体效价>1:64时胎儿风险显著升高。DNA测序技术可辅助解决血清学无法确定的稀有血型,如2018年发现的ABOAW.34新等位基因。
四、技术挑战与发展方向

当前检测仍面临多重挑战。自身免疫性疾病患者体内存在温抗体或冷抗体,可能掩盖真实血型,需通过吸收放散试验分离干扰因素。单克隆抗体试剂的应用虽提高特异性,但对Ax等弱亚型的检测灵敏度仍不足,某实验室对比研究发现,传统抗血清对Ax的漏检率达12%,而分子检测可100%识别。标准化方面,不同厂家的抗血清临界值差异可能导致结果偏差,亟需建立统一质控体系。
未来技术将向多维度发展。微流控芯片可实现微量样本快速检测,2019年某团队开发的芯片检测系统可在5分钟内完成全血分析。质谱技术通过解析红细胞膜糖链结构,能识别传统方法无法区分的变异体。人工智能辅助判读系统已进入临床验证阶段,某三甲医院试用显示,AI对凝集模式的识别准确率达99.3%,显著高于人工判读。这些创新将推动血型检测向精准化、智能化迈进。
五、总结与展望
抗A抗B检测作为血型鉴定的基石,其科学价值贯穿于输血医学发展史。从最初的玻片凝集到全自动分析仪,技术进步不断突破检测极限,但抗原抗体反应的核心原理始终未变。面对临床复杂案例,需综合运用血清学、分子生物学和生物信息学手段,构建多维度检测体系。未来研究应聚焦于稀有血型数据库建设、即时检测设备开发以及个体化输血策略优化,使血型检测更好地服务于精准医疗。正如诺贝尔奖得主Landsteiner所言:"血型不仅是遗传标记,更是生命相容性的密码。"破解这份密码,仍需科研与临床的持续探索。


