人类ABO血型系统的发现开启了免疫血液学的新纪元。其核心在于红细胞表面抗原与血清抗体的特异性反应:A抗原与抗A抗体结合、B抗原与抗B抗体结合均会引发凝集反应,这种抗原-抗体的二元对立构成了血型鉴定的理论基础。正定型检测正是基于此原理,通过标准抗血清与受检红细胞的反应模式确定血型。以A凝集为例,当抗A血清与红细胞表面的A抗原结合时,会形成肉眼可见的颗粒状凝集块,这种凝集现象既是生物学反应的直观呈现,也是临床检测的核心判据。
在抗原抗体反应过程中,温度、pH值、离子强度等环境因素显著影响反应效率。研究发现,IgM型抗A抗体在4℃时亲和力最强,但为避免冷凝集干扰,常规检测多在室温(20-24℃)进行。而红细胞抗原的表达强度存在个体差异,例如A亚型个体的A抗原数量仅为正常A型的25%-50%,这解释了为何部分样本需要延长反应时间或增强离心力才能显现凝集。这些生物学特性决定了检测方法需要根据不同情况进行参数调整。
二、血型正定型检测的技术体系
传统玻片法因其操作简便成为血型初筛的首选。将抗A、抗B血清滴于载玻片,与受检者红细胞悬液混合后,通过肉眼或低倍显微镜观察凝集模式。但该方法对弱抗原的敏感性有限,例如在A2亚型检测中,约15%的样本可能呈现假阴性。研究数据显示,玻片法对标准A型样本的检测准确率达99.2%,但对A亚型的漏检率可达7.3%,这促使临床更多采用试管法进行验证。
现代检测技术已发展出凝胶微柱法、流式细胞术等精准方法。凝胶微柱法利用葡聚糖凝胶的分子筛效应,通过离心后红细胞在凝胶中的沉降位置判断凝集程度,其标准化程度高,能检测到低至200个抗原位点的微弱反应。自动化设备的引入使检测通量提升至每小时300样本,同时将人为误差率从传统方法的0.8%降至0.05%。但高技术门槛也带来新的挑战,例如仪器校准偏差可能导致弱阳性样本误判,这要求实验室建立严格的质量控制体系。
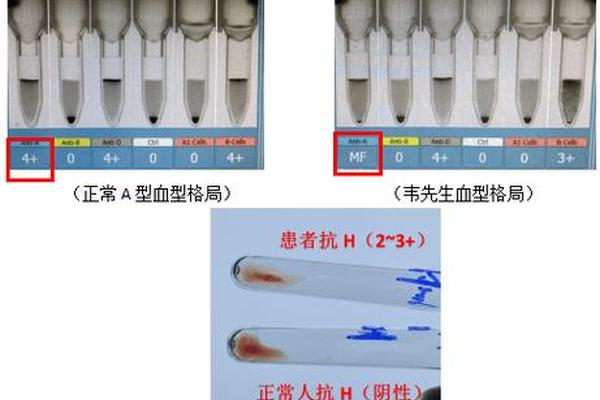
三、凝集图谱的临床解读与误差分析
凝集强度的分级体系是结果判读的核心依据。根据国际血液学标准化委员会(ICSH)指南,将凝集反应分为从-到++++的六级标准:完全凝集(++++)表现为单一凝块,无游离红细胞;弱阳性(+)则需显微镜下观察到5-8个红细胞聚集。值得注意的是,约0.3%的健康个体会出现混合视野凝集(MF),这种特征性表现常提示嵌合体或移植后血型转换等特殊状况。
误差来源的识别是确保检测准确的关键。技术性误差包括抗血清效价衰减(效价低于1:128时假阴性风险增加30%)、红细胞悬液浓度偏差(最佳浓度为2%-5%)等。生物学干扰更为复杂:白血病患者可能出现抗原减弱,类B抗原形成者会呈现异常凝集模式,而自身冷抗体的存在可使所有检测孔出现非特异性凝集。针对这些情况,临床指南建议结合反定型、吸收放散试验等多维度验证,特别是对血型不符的献血者样本需进行基因分型确认。
四、特殊案例的处置与技术创新
新生儿血型鉴定面临独特挑战。胎儿期红细胞抗原表达不完全,出生时A抗原表达量仅为成人的25%,这导致约12%的新生儿正定型结果与6个月后复查结果不一致。解决方案包括使用增强介质(如木瓜蛋白酶处理红细胞)、采用灵敏度更高的单克隆抗体试剂。而对于ABO血型不合的器官移植,最新研究显示通过血浆置换降低抗体效价至1:8以下,可将急性排斥反应发生率从58%降至17%。
分子诊断技术的突破正在重塑血型鉴定格局。PCR-SSP法能准确识别ABO基因的6种主要单核苷酸多态性,对亚型的鉴别准确率比血清学方法提高40%。质谱流式技术更可同时检测500个红细胞抗原表位,为稀有血型鉴定提供新思路。但技术转化面临成本瓶颈,目前基因分型检测费用仍是常规方法的5-8倍,限制其在基层医院的普及。

五、质量体系构建与未来展望
标准化操作流程的建立是检测质量的基石。包括每日进行试剂质控(抗血清效价≥1:128)、每月参加室间质评、建立样本追溯系统等。培训体系也需革新,虚拟现实(VR)模拟训练可使技术人员在虚拟实验室中掌握弱凝集判读技巧,错误操作率较传统培训降低62%。而区块链技术的应用,使从样本采集到报告签发的全流程数据不可篡改,这对输血安全具有革命性意义。
未来研究将聚焦于三个方向:一是开发超灵敏纳米传感器,实现单细胞水平抗原检测;二是建立中国人群ABO亚型数据库,目前已收录的327例A亚型样本为精准医疗提供数据支撑;三是探索血型抗原在肿瘤免疫、感染性疾病中的新功能。这些进展将推动血型检测从单一的输血配型工具,发展为个体化医疗的重要组成部分。
通过系统性梳理可见,血型正定型中A凝集的判读既是基础技术,又是精密科学。从抗原抗体反应的分子机制到自动化设备的智能算法,从常规检测的质量控制到特殊案例的处置策略,每个环节都凝聚着百年血液学研究的智慧结晶。在精准医学时代,唯有持续技术创新与严格质量管理相结合,才能确保这项百年检测技术持续守护输血安全。


