在人类复杂的血液系统中,ABO与Rh两大血型系统构筑起生命传递的安全防线。其中,A型血作为ABO系统的重要成员,不仅存在A1、A2等亚型分化,更与Rh阴性特征结合形成"A-"这一特殊血型。这些细微的抗原差异背后,蕴含着免疫学反应的奥秘,也深刻影响着临床输血的安全边界。理解A1亚型与A-血型的本质区别,不仅是对生命密码的解读,更是现代医学精准化发展的必经之路。
一、血型分类系统的生物学基础
ABO血型系统以红细胞表面抗原为分类依据,A型血的特征性标志是存在A抗原。1900年兰德施泰纳发现该系统的划时代意义在于揭示了血液的个体差异性,其学生随后发现的AB型完善了该分类体系。在A型群体中,约80%属于A1亚型,其红细胞表面A抗原密度是A2亚型的5-10倍,这种量的差异源于糖基转移酶活性的不同。抗原密度的显著区别使得A1亚型在交叉配血时可能引发弱凝集反应,这对输血安全提出了更高要求。

Rh血型系统的发现则源于恒河猴实验,D抗原的存在与否将人群分为Rh阳性(如A+)与Rh阴性(如A-)。我国汉族人群中Rh阴性仅占0.3%-0.4%,这种稀有性使A-血型被称为"熊猫血"。抗原表达的分子机制上,RhD阳性者编码D抗原的基因呈现显性遗传,而Rh阴性个体在该基因位点存在缺失或突变。
二、血清学特性与临床意义
A1亚型的血清学特征表现为抗-A1抗体的潜在存在。约1%-8%的A2型个体血清中含有天然抗-A1抗体,当接受A1型血液时可能引发溶血反应。这要求血库在进行A型血细分时,需采用特殊抗血清检测亚型差异。临床案例显示,曾有A2型患者输入A1型红细胞后出现血红蛋白尿,证实了亚型不兼容的临床风险。
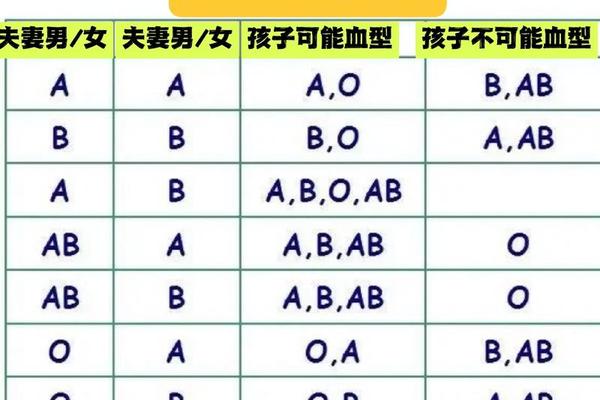
对于A-血型而言,其临床重要性体现在妊娠与输血两个维度。Rh阴性孕妇若孕育Rh阳性胎儿,胎儿的红细胞可能通过胎盘引发母体免疫反应,导致新生儿溶血病。统计显示,未进行抗D免疫球蛋白预防的Rh阴性产妇,第二胎发生溶血症的概率可达16%。在输血实践中,A-患者原则上只能接受A-或O-血液,但在紧急情况下,最新指南允许限量输注Rh阳性血液,但需严格监测抗体产生。
三、遗传学机制与分子基础
ABO基因位于9号染色体长臂,其等位基因通过编码不同的糖基转移酶决定抗原类型。A1亚型由ABOA1.01等位基因控制,该基因在第六外显子存在1061C>D突变,导致酶活性增强。而A2亚型则因467C>T突变使酶蛋白结构改变,催化效率降低。这种单核苷酸多态性(SNP)差异,可通过PCR-RFLP技术精准鉴别。
Rh血型系统涉及两个紧密连锁的基因RHD和RHCE。在Rh阴性个体中,RHD基因常呈现全基因缺失或移码突变。亚洲人群特有的RHD伪基因等位基因,会导致D抗原表位缺失,形成弱D表型。分子诊断技术的发展,使临床能准确区分真性Rh阴性、部分D型等亚类,将输血反应率降低至0.01%以下。
四、社会与医学应用的延伸
建立区域性稀有血型库成为保障A-患者用血安全的关键。我国自2001年启动"中国稀有血型库"建设,通过冷冻红细胞技术将保存期限延长至10年,目前库存量已覆盖85%的应急需求。对于A1亚型,部分发达国家开始推行"精准配型"输血,通过MALDI-TOF质谱技术检测抗原表位,将红细胞输注匹配精度提升至99.99%。
在法医学领域,ABO血型曾长期作为亲子鉴定的重要指标。但A1亚型的遗传规律(如A2型父母可能生出O型子女)曾引发诸多误判。随着STR基因分型技术的普及,血型系统的鉴定价值已从直接证据转变为辅助证据。而在人类学研究方面,A1亚型在欧洲的高频率分布(约32%)与A2在非洲的富集现象(约45%),为人群迁徙研究提供了分子标记。
生命科学的发展正在重塑血型认知的边界。CRISPR基因编辑技术在小鼠模型中成功实现RhD抗原的人工表达,为Rh阴性患者自体干细胞改造带来曙光。而对ABO糖基转移酶的蛋白质工程研究,已实现体外合成通用型O型红细胞,这项突破或将彻底改变血源供应格局。站在新的历史节点,对A1亚型与A-血型的深入研究,不仅是输血医学的基石,更是打开免疫耐受、细胞工程等前沿领域的钥匙。未来,随着单细胞测序与合成生物学技术的融合,个性化血液制品的时代正在加速到来。


