在医疗急救和手术过程中,输血是挽救生命的重要技术手段。ABO血型系统中,AB型作为"万能受血者"的理论曾长期主导临床实践,但随着免疫学研究的深入,人们发现这种认知存在严重误区。A型血与AB型血之间的输血关系,正是揭开血型相容性复杂本质的典型案例。本文将围绕抗原抗体反应原理、交叉配血试验机制及临床实践规范三个维度,系统解析A型血液输入AB型受体的可行性及其潜在风险。
一、ABO血型系统的抗原抗体基础
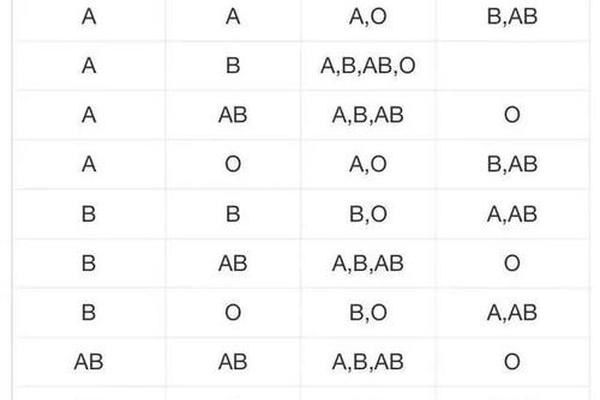
ABO血型系统的核心特征在于红细胞膜表面抗原与血清抗体的特异性对应关系。AB型个体的红细胞同时携带A、B两种抗原,而其血清中既不含有抗A抗体也不含有抗B抗体。这种独特的抗原抗体配置,使其理论上能够接受任何ABO血型的红细胞输入,这也是其被称为"万能受血者"的生物学基础。
A型血个体的红细胞表面仅携带A抗原,而血清中含有高浓度的抗B抗体。当A型全血输入AB型受体时,供体红细胞表面的A抗原与受体血清不存在抗体冲突,但供体血浆中的抗B抗体将与受体红细胞表面的B抗原发生免疫反应。这种双向免疫作用的存在,使得全血输注可能引发溶血反应,但经处理的纯化红细胞制品则具备安全输注的可行性。
现代免疫学研究证实,AB型血清中IgM类天然抗体的缺失,使其对异型红细胞输入具有较高耐受性。但IgG类免疫抗体仍可能通过妊娠、输血等途径产生,这种获得性抗体的存在会显著改变输血相容性评估。即便在ABO同型输血时,仍需严格执行交叉配血试验。
二、交叉配血试验的科学机制
交叉配血试验包括主侧配血(供体红细胞+受体血清)和次侧配血(受体红细胞+供体血清)两个关键环节。在A型血输注AB型受体的场景中,主侧配血因受体血清无抗A抗体而呈阴性,这为红细胞输注提供了基础安全性。但次侧配血会显示阳性反应,因供体血清中的抗B抗体与受体红细胞的B抗原发生凝集。
临床实践中,当主侧配血阴性而次侧阳性时,允许在严密监护下进行限量输注。这种特殊处理源于红细胞悬液制品中血浆含量极低的特点。现代血站制备的红细胞制品,血浆残留量通常低于30ml,其中的抗体浓度经生理盐水稀释后,难以引发显著溶血反应。但全血输注时,血浆抗体浓度可达到危险水平,这也是O型全血不能作为"万能血"的根本原因。
输血反应的时相性特征要求临床特别注意。急性溶血反应多在输血后24小时内发生,主要表现为寒战、血红蛋白尿和肾功能衰竭;迟发性反应则可能出现在输血后数日,由记忆性免疫应答引发。这些反应机制的存在,要求即便在紧急输血后仍需持续监测受体生命体征至少72小时。
三、临床实践规范与风险控制
成分输血技术的普及从根本上改变了传统输血模式。A型洗涤红细胞制品通过去除99%以上的血浆成分,将抗B抗体含量降至安全阈值以下,成为AB型患者可接受的异型红细胞来源。临床数据显示,单次输注2单位洗涤红细胞引发的抗体效价升高幅度不超过4倍,在无既往致敏史的患者中具有可接受的安全性。
紧急输血规程设定了明确的操作边界。当AB型血源短缺时,可依次选择A型、B型洗涤红细胞进行替代,但24小时内输注总量不得超过4单位,且必须同步进行抗体筛查。这种限制既考虑到抗体累积效应,也防范了输血相关移植物抗宿主病(TA-GVHD)等罕见并发症。对于需要大量输血的患者,建议采用血浆置换术清除供体抗体,维持输血通道的持续安全。
输血医学的发展正在突破传统ABO限制。基因编辑技术制备的通用型红细胞已进入临床试验阶段,这种敲除ABO抗原的红细胞制品可安全用于各血型患者。人工血液的研制也取得突破性进展,基于血红蛋白氧载体的代用品在动物实验中已实现72小时循环支持。这些技术进步将重构未来的输血格局,但现阶段严格遵循同型输血原则仍是医疗安全的基石。
ABO血型系统的复杂性在A型与AB型的输血实践中得到充分体现。血清抗体与红细胞抗原的相互作用机制,决定了异型输血的潜在风险与实施边界。现代输血医学通过成分分离技术、精密配型检测和规范操作流程,在生命救治与风险控制间建立了动态平衡。未来随着基因工程血液制品和人工氧载体的临床应用,输血医学将进入精准化、个性化的新纪元。但现阶段临床工作者仍需恪守输血基本原则:坚持同型输注为首选,严格交叉配血试验,审慎实施异型输血,方能在救治生命的同时最大限度保障医疗安全。


