在人类的血液中,红细胞表面的抗原如同生物密码般决定了个体间的输血相容性,其中A型血特有的凝集原不仅是免疫识别的关键标记,更在医学检验、遗传学研究等领域发挥着枢纽作用。当A型红细胞与抗A血清相遇时发生的特异性凝集反应,不仅构建了血型检测的基础逻辑,其背后更蕴含着糖基转移酶的精密调控与基因表达的复杂机制。通过显微镜下如星辰般聚集的红细胞凝块,人类得以窥见生命科学中最具临床价值的分子识别系统之一。
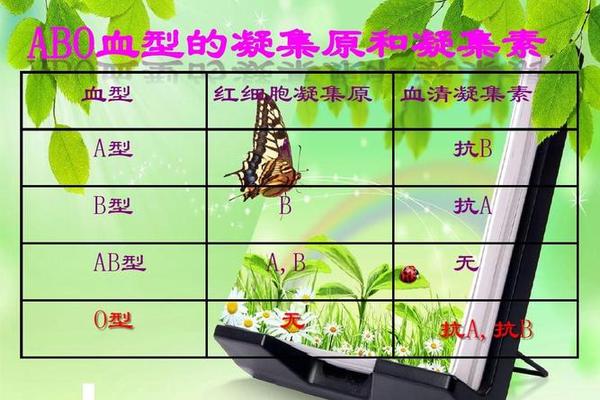
一、A型凝集原的分子结构
A型凝集原的本质是镶嵌在红细胞膜表面的糖脂复合物,其核心结构由H抗原演变而来。H抗原本身是岩藻糖通过α-1,2糖苷键连接到前体物质乳糖胺末端半乳糖的产物,而A型特异性则源于N-乙酰半乳糖胺(GalNAc)在H抗原基础上的进一步修饰。这种修饰过程由位于9号染色体的A基因编码的α-1,3-N-乙酰半乳糖胺转移酶催化完成,该酶能精准地将GalNAc连接到H抗原的半乳糖基团上,形成独特的A型抗原决定簇。
从立体构象来看,A型抗原的三维空间排布具有高度特异性。X射线晶体学研究表明,GalNAc的乙酰氨基与相邻糖环形成的氢键网络,构成了抗体结合的关键表位。这种空间构型使得抗A抗体能通过Fab段的互补决定区(CDR)与之形成多点结合,而B型抗原由于末端半乳糖缺乏乙酰基团,其表面电荷分布与空间构象与A型存在显著差异。这种分子层面的差异正是ABO血型系统区分的基础。
二、凝集反应的免疫学机制
当A型红细胞遭遇抗A抗体时,免疫球蛋白的Fc段首先与红细胞膜表面补体受体结合,引发抗体桥联效应。每个IgM五聚体分子可同时结合多个A抗原表位,形成三维交联网络。这种多价相互作用产生的强大结合力足以克服红细胞表面负电荷的排斥作用,导致细胞膜变形、膜流动性改变,最终形成肉眼可见的凝集块。实验数据显示,抗A抗体与A型红细胞的结合常数可达10^8 M^-1,而与非A抗原的结合效率降低三个数量级,这种高特异性源于抗原-抗体界面的精确分子互补。
凝集反应的动力学过程呈现明显的温度依赖性。在4℃条件下,冷抗体介导的凝集反应显著增强,这与其IgM型抗体的结构特性相关——低温环境下,IgM的构象变化使其更易展开并与抗原结合。而37℃时,热力学运动增强导致部分弱结合解离,这也解释了为何临床输血需在体温条件下进行交叉配血试验。通过原子力显微镜观察发现,单个抗A抗体可在红细胞表面形成约20nm的局部膜变形,多个此类变形的协同作用最终引发细胞间交联。
三、血型检测的技术演进
传统的玻片凝集法通过肉眼观察凝集现象,其灵敏度取决于抗体效价与红细胞浓度。标准操作要求将抗A血清与待检血液按1:5比例混合,通过牙签划动促进抗原抗体接触。但该方法存在主观判读偏差,对弱A亚型的检测灵敏度不足(如A2型漏检率可达5%)。现代凝胶微柱技术通过离心力使未凝集细胞穿过凝胶基质,仅凝集团滞留在反应腔顶部,利用光密度扫描定量分析灰度值,将检测灵敏度提升至0.1%抗原表达水平。

分子诊断技术的突破使血型鉴定进入基因层面。PCR-RFLP法通过特异性引物扩增ABO基因第6、7外显子,利用限制性内切酶KpnI和AluI的酶切位点差异区分A、B、O等位基因。二代测序技术更可检测启动子区单核苷酸多态性(SNP),准确识别cisAB、B(A)等罕见变异型。临床数据显示,基因分型与血清学方法的符合率达99.7%,但对孟买型等H抗原缺陷型的诊断仍需结合血清学试验。
四、临床输血的生物安全
A型受血者的血浆中天然存在抗B凝集素,这使得其仅能接受A型或O型供血。但O型血中残留的抗A抗体(效价≤1:64)在大剂量输血时仍可能引发迟发性溶血反应。研究显示,当输入O型红细胞量超过患者血容量50%时,供者血浆抗体导致的溶血发生率从0.3%升至2.1%。因此现行指南建议,除紧急抢救外,异型输血量应控制在2单位以内,且需监测血浆游离血红蛋白水平。
在器官移植领域,供受体ABO血型不符会引发超急性排斥反应。肝移植的跨血型耐受机制研究揭示,肝窦内皮细胞表达的A抗原可通过"抗原修饰"途径诱导T细胞凋亡,这使得肝移植的ABO不相容阈值可放宽至IgG抗A效价1:8以下。但心脏、肾脏等实体器官移植仍严格遵循同型原则,因血管内皮细胞的强抗原表达会激活补体级联反应。
五、遗传进化与群体差异
ABO基因的进化树分析显示,A等位基因在旧大陆猴中已存在原型。人类A型基因的特异性突变(261delG)可能源于40万年前的基因转换事件,该突变导致糖基转移酶活性中心的重构。群体遗传学数据显示,A型基因频率在欧洲人群达40%,而在美洲原住民中不足10%,这种差异可能与特定病原体(如鼠疫杆菌)的选择压力相关——A抗原与鼠疫杆菌荚膜多糖的分子模拟可能赋予某些免疫优势。
表观遗传调控对A抗原表达的影响近年备受关注。DNA甲基化测序发现,ABO基因启动子区CpG岛的甲基化程度与抗原密度呈负相关。在白血病患者中,异常的全局低甲基化可导致A抗原表达增强2-3倍,这种现象可能干扰血型鉴定结果。microRNA-657被证实可通过结合ABO mRNA 3'UTR抑制翻译,这为开发抗原表达调控疗法提供了新靶点。
A型血凝集原的研究历程,折射出人类对生命密码的解读从现象观察走向分子机制探索的科学发展轨迹。当前研究已突破血清学表象,深入基因编辑、单分子成像等前沿领域。未来研究可聚焦于三方面:开发纳米级抗原定量检测技术以提高稀有血型识别精度;解析糖基转移酶催化机理以设计人工抗原修饰系统;建立跨血型移植的免疫耐受诱导方案。这些突破将推动输血医学从"适配"向"调控"阶段跨越,最终实现个体化精准血液治疗体系的构建。


