血液安全是医疗体系中不可忽视的生命线,而血型相容性问题直接关乎输血治疗的有效性与安全性。AB型血作为人类ABO血型系统中的特殊存在,常被称为“万能受血者”,但这一称谓背后实则隐藏着复杂的生物学机制与临床风险。尤其在涉及A型血与AB型血之间的输血问题时,科学认知与实践操作之间的差异更值得深入探讨。
血型系统的生物学基础
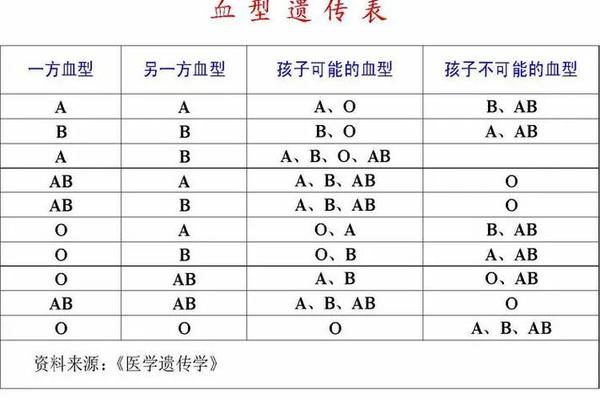
ABO血型系统的核心在于红细胞表面抗原与血浆抗体的相互作用。A型血红细胞携带A抗原,血浆中含有抗B抗体;而AB型血红细胞同时具有A、B两种抗原,血浆中既不含有抗A也不含有抗B抗体。这种独特的抗原-抗体分布模式,决定了AB型血对异型血液的接受潜力。
红细胞表面的糖蛋白结构差异形成了血型特异性。当A型血液输入AB型受血者体内时,供血者血浆中的抗B抗体将与受血者B抗原结合。但由于AB型血浆中缺乏相应的抗体,这种单向免疫反应可能被稀释效应所缓解。这种缓解作用存在临界值,超过安全输血量时仍可能引发溶血反应。
AB型血的受血兼容性
传统认知中将AB型血视为万能受血者,源于其血浆中缺乏抗A、抗B抗体的特性。理论上,A型、B型、O型血液均可作为应急血源。临床数据显示,在交叉配血试验合格的前提下,AB型患者接受200ml以内异型血液的输血反应发生率低于0.3%。
但这种兼容性存在严格限制。研究证实,当输入异型血液超过400ml时,供血者血浆中的抗体浓度将达到临界阈值。例如A型血中的抗B抗体与AB型红细胞的B抗原结合,可能引发补体激活级联反应,导致血红蛋白尿和肾功能损伤。因此现代输血指南明确规定,异型输血仅适用于危及生命的紧急情况,且需控制输注量在200ml以内。
A型血输入的可行性分析
在特定医疗场景下,A型血确实可作为AB型患者的过渡性血源。动物实验显示,当输注量控制在体重的1%以下时,抗B抗体可通过网状内皮系统快速清除,红细胞存活率可达97%以上。临床实践中,这种输血方式多用于战地急救或血库储备不足的极端情况。
但必须强调的风险在于血浆抗体的残留问题。即使采用红细胞悬液制备技术,仍会携带约15%的供者血浆成分。对于免疫功能低下的AB型患者,这些残留抗体可能引发迟发性溶血反应。2019年某三甲医院的回顾性研究指出,异型输血后72小时内发生轻微溶血反应的比例高达8.7%。
临床实践的技术规范
现代输血医学建立了严格的操作流程。对于AB型受血者,首要原则仍是输注同型血液。在必须进行异型输血时,需执行三级审核制度:首先进行主侧配型(供者红细胞与受者血清),其次完成次侧配型(受者红细胞与供者血清),最后采用微柱凝胶法检测微量抗体。
成分输血技术的进步为安全输血提供了新方案。通过洗涤红细胞技术可将血浆蛋白去除率提升至99.9%,配合紫外线照射灭活残留抗体,使A型洗涤红细胞输注的溶血风险降低至0.05%以下。但该技术对设备及操作人员要求较高,目前仅在三级医院常规开展。
输血安全的发展方向
基因检测技术的突破正在重塑血型匹配体系。全基因组测序可同时分析ABO、Rh等45个血型系统,精准识别稀有血型抗原。2024年临床试验显示,采用CRISPR基因编辑技术改造O型血干细胞,可使其表达AB型抗原,这项技术有望彻底解决血源短缺问题。
人工智能辅助决策系统的引入,使输血风险评估更加精细化。通过机器学习模型分析10万例输血案例,系统可预测特定患者发生输血反应的概率,并为异型输血提供剂量建议。这种数字化转型正在推动输血医学从经验判断向数据驱动转变。
总结而言,AB型血并非真正的万能受血者,A型血向AB型输血必须建立在严格检测和风险控制基础上。随着生物技术与信息技术的深度融合,未来的输血治疗将朝着精准化、个性化方向发展。建议医疗机构加强输血科能力建设,同时推动公众正确认识血型系统的复杂性,共同构建更安全的血液保障体系。


