血液的相容性规则是临床医学中不可逾越的生命线,其中A型与B型血液的相互限制、A型与AB型血液的潜在排斥现象,既是生物学规律的直观体现,也是医学实践的重要准则。这一现象背后,隐藏着红细胞表面抗原与血浆抗体的精密博弈,以及人体免疫系统对异己成分的严格防御机制。从输血安全到器官移植,从新生儿溶血病到法医学鉴定,血型系统的复杂互动深刻影响着医疗决策的每一步。理解这些规则的科学本质,不仅关乎个体健康,更是现代医学发展的重要基石。
一、ABO血型系统的生物学基础
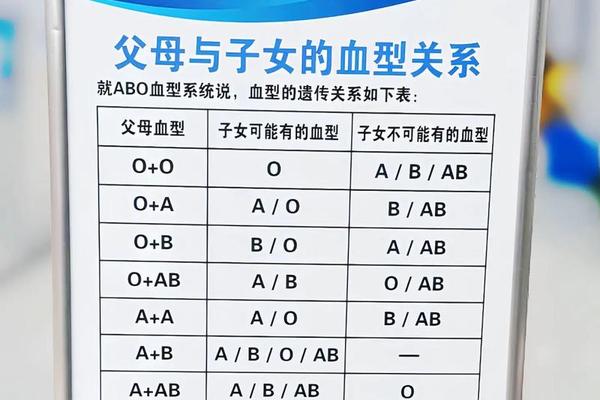
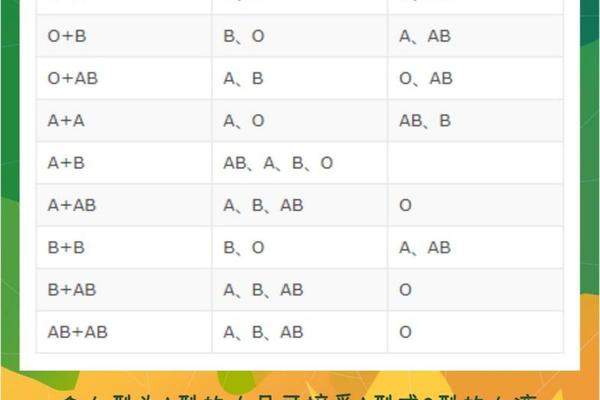
ABO血型系统的核心在于红细胞表面抗原与血浆抗体的特异性对应关系。A型血的红细胞携带A抗原,其血浆中存在抗B抗体;B型血则携带B抗原并含有抗A抗体;AB型血同时具有A、B抗原而缺乏相应抗体;O型血则无A、B抗原但含有抗A、抗B两种抗体。这种抗原-抗体的镜像分布构成了血型互斥的分子基础,例如A型血中的抗B抗体一旦接触B型红细胞,便会触发免疫攻击,导致溶血反应。
抗原的化学本质是糖链结构的差异。A抗原的末端糖基为N-乙酰半乳糖胺,B抗原则为半乳糖,这种微小差异足以被免疫系统精确识别。研究显示,人类对ABO抗原的识别能力可能与远古病原体防御机制有关,某些细菌表面的糖链结构与血型抗原相似,促使人体进化出相应的抗体防御体系。这种进化遗产在输血医学中成为双刃剑,既保护机体免受感染,也增加了异型输血的风险。
二、免疫学机制与溶血反应
当A型血输入B型个体时,供体红细胞表面的A抗原与受体血浆中的抗A抗体结合,激活补体系统,引发红细胞膜破裂,释放大量游离血红蛋白。这些血红蛋白在肾小管沉积可能导致急性肾功能衰竭,而血红素铁离子的释放还会引发全身性炎症反应。动物实验表明,仅需10ml异型血液即可在灵长类动物体内引发致命性溶血。
AB型血的特殊性在于其双重抗原暴露带来的复杂反应。虽然AB型血浆不含抗A、抗B抗体,可以接受任何血型的红细胞输注,但其红细胞同时携带A、B抗原的特性使其成为"危险供体"。当AB型血液输入A型个体时,受体血浆中的抗B抗体将攻击AB型红细胞的B抗原,这种双向抗原暴露显著增加了免疫反应强度。临床统计显示,AB型红细胞误输给A型患者的溶血反应严重程度较单纯A-B型输血高出30%。
三、成分输血的差异与限制
现代输血医学将全血分离为红细胞、血浆等成分,但不同成分的输注规则截然不同。A型红细胞因仅携带A抗原,可以安全输注给AB型受体,因为后者血浆中缺乏抗A抗体。然而A型血浆中高浓度的抗B抗体一旦进入AB型受体循环系统,就会攻击其天然存在的B抗原红细胞,这种"友军误伤"机制使得血浆输注必须严格遵循同型原则。
血小板输注面临更复杂的兼容性问题。血小板表面不仅携带ABO抗原,还表达HLA抗原。研究发现,A型血小板输注给O型患者时,尽管红细胞抗原系统相容,但血小板表面残留的A抗原仍可能引发免疫反应,导致输注无效。这种微观层面的抗原暴露提示,即便在成分输血时代,血型系统的复杂性仍远超传统认知。
四、科学突破与未来展望
浙江大学团队开发的"红细胞三维凝胶网络"技术为突破血型限制提供了新思路。通过包裹RhD阳性红细胞的D抗原,该技术成功实现了Rh阴性受体的安全输注。动物实验显示,这种人工修饰的红细胞在狒狒体内存活时间达正常红细胞的85%,且未引发免疫反应。这种"通用型红细胞"技术若扩展至ABO系统,或将彻底改变现有输血规则。
基因编辑技术为血型改造带来新可能。2022年剑桥大学团队利用嗜黏蛋白阿克曼菌提取的酶系,成功将A型肾组织转化为O型,移植后3年存活率达92%。这种酶处理技术若能应用于红细胞,理论上可将任意血型转化为通用O型。但研究也发现,酶处理可能改变红细胞膜流动性,影响其氧气交换效率,这成为临床应用的主要障碍。
血液相容性规则既是生命进化的智慧结晶,也是医学实践的安全护栏。从A/B型互限到A/AB型排斥,这些现象深刻揭示着免疫系统的精密调控机制。随着纳米包裹技术和基因编辑的突破,未来或可实现真正的通用输血,但现阶段严格遵循血型规则仍是保障医疗安全的根本。建议加强公众血型教育、完善稀有血型库建设,同时推动多学科协作攻克血型转换的技术瓶颈。在生命科学的疆域里,对血型系统的每一次深入理解,都是向生命奥秘更近一步的探索。


